ქოლესტერინის ბიოსინთეზი და მისი ბიოქიმია - დიაბეტი
ეჭვგარეშეა, რომ ქოლესტერინი ყველაზე ცნობილი ლიპიდურია ფართო საზოგადოებისთვის; ის ცნობილია მაღალი სისხლის ქოლესტერინის და ადამიანის გულ-სისხლძარღვთა დაავადებების სიხშირეს შორის მაღალი კორელაციის გამო. ნაკლები ყურადღება დაეთმო ქოლესტერინის მნიშვნელოვან როლს, როგორც უჯრედული მემბრანების კომპონენტს და როგორც სტეროიდული ჰორმონების და ნაღვლის მჟავების წინამორბედი. ქოლესტერინი აუცილებელია მრავალი ცხოველისთვის, მათ შორის ადამიანისთვის, მაგრამ მისი არსებობა ძუძუმწოვრების საკვებში არის სურვილისამებრ - სხეულის უჯრედებს თავად შეუძლიათ მისი სინთეზირება მარტივი წინამორბედებისგან.
ამ 27 ნახშირბადის ნაერთის სტრუქტურა გვთავაზობს რთულ გზას მისი ბიოსინთეზისთვის, მაგრამ მის ნახშირბადის ყველა ატომს უზრუნველყოფს ერთი პრეკურსორი - აცეტატი. იზოფრენის ბლოკები - აცეტიდან დაწყებული ქოლესტერინის ყველაზე მნიშვნელოვანი შუალედები, ისინი მრავალი ბუნებრივი ლიპიდების წინამორბედია, ხოლო მექანიზმები, რომლითაც იზოფრენის ბლოკები პოლიმერიზებულია, მსგავსია ყველა მეტაბოლურ გზაში.
ჩვენ ვიწყებთ აცეტატიდან ქოლესტერინის ბიოსინთეზის გზაზე ძირითადი ეტაპის შემოწმებას, შემდეგ განვიხილავთ ქოლესტერინის ტრანსპორტირებას სისხლის მიმოქცევის გზით, უჯრედების მიერ მისი შეწოვაზე, ქოლესტერინის სინთეზის ნორმალურ რეგულირებაზე და რეგულირებაზე დაქვეითებული შეწოვის ან ტრანსპორტის შემთხვევაში. შემდეგ ჩვენ ვუყურებთ სხვა ნივთიერებებს, რომლებიც მოდის ქოლესტერინისგან, მაგალითად, ნაღვლის მჟავები და სტეროიდული ჰორმონები. დაბოლოს, ბიოსინთეზური ბილიკების აღწერა მრავალი ნაერთის - იზოპრენის ბლოკების წარმოქმნების შესახებ, რომლებშიც არსებობს ქოლესტერინის სინთეზის საერთო ადრეული სტადიები, წარმოგიდგენთ ბიოინთეზში იზოფრენოიდული კონდენსაციის არაორდინალურ მრავალფეროვნებას.
ქოლესტერინი წარმოიქმნება აცეტილ-CoA- სგან ოთხ ეტაპზე
ქოლესტერინი, ისევე როგორც გრძელი ჯაჭვის ცხიმოვანი მჟავები, მზადდება აცეტილ-CoA- სგან, მაგრამ ასამბლეის ნიმუში სრულიად განსხვავებულია. პირველ ექსპერიმენტებში ცხოველების საკვებს დაემატა აცეტი 14 label C ეტიკეტით ან მეთილის ან კარბოქსილის ნახშირბადის ატომში. ცხოველების ორი ჯგუფიდან იზოლირებულ ქოლესტერინში ეტიკეტის განაწილების საფუძველზე აღწერილი იქნა ქოლესტერინის ბიოსინთეზის ფერმენტული სტადიები.
სურ. 21-32. ქოლესტერინის ნახშირბადის ატომების წყარო. იდენტიფიცირებულია ექსპერიმენტების დროს, რადიოაქტიური აცეტატის გამოყენებით, შეაფასა მეთილის ნახშირბადის (შავი) ან კარბოქსილის ნახშირბადის (წითელი). შედედებული სტრუქტურაში, ბეჭდები აღინიშნება ასოებით დ – მდე ასოებით.

სინთეზი ხდება ოთხ ეტაპზე, როგორც ნაჩვენებია ნახ. 21-33: (1) სამი აცეტატის ნარჩენების კონდენსაცია, რომ შეიქმნას მეივონატის ექვსი ნახშირბადიანი შუალედი, (2) მეგალონატის გადაქცევა გააქტიურებულ იზოფრენულ ბლოკად, (3) ექვსი ხუთ ნახშირბადის იზოფრენის ერთეული პოლიმერიზაცია, რათა შეიქმნას 30 ნახშირბადის წრფივი სკალლენი, (4) ციალენის ფორმირება სტეროიდული ბირთვის ოთხი რგოლი, რასაც მოჰყვა ცვლილებები რიგითობით (ჟანგვა, მეთილის ჯგუფების მოცილება ან მიგრაცია) ქოლესტერინის წარმოქმნით.
სურ. 21-33. ქოლესტერინის ბიოსინთეზის განზოგადებული სურათი. სინთეზის ოთხი ეტაპია განხილული ტექსტში. იზოფრენის ბლოკები სკალალონში აღინიშნება წითელი გამონაყარის ხაზებით.

სცენა (1) მევალონატის სინთეზი აცეტატიდან. ქოლესტერინის ბიოსინთეზის პირველი ეტაპი იწვევს შუალედური პროდუქტის ფორმირებას მევალონატი (სურ. 21-34). აცეტილ CoA –ის ორი მოლეკულა შედედებულია აცეტოაცილის CoA– ს მისაცემად, რომელიც მესამე აცეტილ CoA მოლეკულთან ერთად კონდენსატორდება ექვს ნახშირბადის ნაერთის შესაქმნელად. β-ჰიდროქსი-β-მეთილგლუტარილ-CoA (HM G -CoA). ეს ორი პირველი რეაქცია კატალიზირებულია თილაზა და შესაბამისად, NM G -CoA სინთეზა. ციტოზური NM G-CoA სინთაზა ეს მეტაბოლური გზა განსხვავდება მიტოქონდრიული იზოენზიმისგან, რომელიც კატალიზირებს NM G-CoA სინთეზს კეტონის სხეულების ფორმირების დროს (იხ. ნახ. 17-18).
სურ. 21-34. მეგალონატის ფორმირება აცეტილ-CoA- სგან. აცეტილ-CoA- დან C-1 და C-2 მეგალონატის წყარო ხაზგასმულია ვარდისფერში.

მესამე რეაქცია ზღუდავს მთელი პროცესის სიჩქარეს. მასში, NM G -CoA მცირდება mevalonate, რისთვისაც თითოეული NA D PH მოლეკულა უზრუნველყოფს ორ ელექტრონს. HMG-CoA რედუქტაზა - გლუვი ER- ის ინტეგრალური მემბრანული ცილა, ის ემსახურება, როგორც მოგვიანებით ვნახავთ, როგორც ქოლესტერინის წარმოქმნის მეტაბოლური გზის რეგულირების მთავარ პუნქტს.
სცენა (2). მეგალონატის გადაქცევა ორ გააქტიურებულ იზოფრენად. ქოლესტერინის სინთეზის შემდეგ ეტაპზე, სამი ფოსფატის ჯგუფი გადადის ATP მოლეკულებიდან მეევონატში (ნახ. 21-35). ფოსფატი, რომელიც მიეკუთვნება ჰიდროქსილის ჯგუფს C-3 mevalonate- ს შუალედურ 3-ფოსფო-5-პიროფოსფომევონონატში, კარგი ტოვებს ჯგუფს, შემდეგ ეტაპზე ამ ფოსფატებისა და მიმდებარე კარბოქსილის ჯგუფის დატოვება ხდება, რაც ორმაგ კავშირს ქმნის ხუთ ნახშირბადის პროდუქტში ∆ 3 -იზოფენტენილის პიროფოსფატი. ეს არის პირველი ორი აქტივირებული იზოფრენიდან - ქოლესტერინის სინთეზის მთავარი მონაწილეები. Δ 3 –იზოფენტენილფირფოსფატის იზომერიზაციას იძლევა მეორე გააქტიურებული იზოფრენი დიმეთილალურად პიროფოსფატი. იზოპენტენილის პიროფოსფატის სინთეზი მცენარეთა უჯრედების ციტოპლაზმაში ხდება აქ აღწერილი ბილიკის შესაბამისად. ამასთან, მცენარეთა ქლოროპლასტები და მრავალი ბაქტერია იყენებენ მივალონატისგან დამოუკიდებელ გზას. ეს ალტერნატიული გზა ცხოველებში არ გვხვდება, ამიტომ ახალი ანტიბიოტიკების შექმნისას მიმზიდველია.
სურ. 21-35. მეგალონატის გადაქცევა გააქტიურებული იზოფრენის ბლოკად. ექვსი გააქტიურებული ერთეული გაერთიანდება სკალალენის ფორმირებისთვის (იხ. სურათი 21-36). 3-ფოსფო-5-პიროფოსფომივალონატის შემცველი ჯგუფები ხაზგასმით აღინიშნება ვარდისფერში. კვადრატულ ფრჩხილებში არის ჰიპოთეტური შუამავალი.

სცენა (3). ექვსი გააქტიურებული იზოფრენის ერთეული კონდენსაცია სკალალენის ფორმირებისთვის. იზოპენტენილის პიროფოსფატი და დიმეთილალილ პიროფოსფატი ახლა გადის თავ-კუდის კონდენსაციას, რომელშიც მოძრაობს ერთი პიროფოსფატის ჯგუფი და ხდება 10 ნახშირბადის ჯაჭვი. - გერანილის პიროფოსფატი (სურ. 21-36). (პიროფოსფატი თავთან მიმაგრებულია.) გერანილის პიროფოსფატი გადის შემდეგ - კუდის კონდენსაციას იზოპენტენილის პიროფოსფატთან და 15 ნახშირბადოვანი შუალედური ფორმით. ფარნესილის პიროფოსფატი. დაბოლოს, ფარნსილის პიროფოსფატის ორი მოლეკულა გაერთიანებულია "თავში თავთან", ამოღებულია ფოსფატის ჯგუფები - იქმნება სკალელი.
სურ. 21-36. სკალელის ფორმირება. სკალინის სტრუქტურა, რომელიც შეიცავს 30 ნახშირბადის ატომს, ხდება იზოფრენის (ხუთ ნახშირბადის) ბლოკებით გააქტიურებული თანდათანობითი კონდენსაციების დროს.

ამ შუამავლების საერთო სახელები მომდინარეობს იმ წყაროების სახელებიდან, საიდანაც პირველად იზოლირებულ იქნა. ჟერანიოლს, ვარდის ზეთის კომპონენტი, აქვს გერანიუმის არომატი, ხოლო ფარნაზოლს, რომელიც აკაციის ფერნანას ფერებში გვხვდება, ველური არომატის შროშანი აქვს. მრავალი ბუნებრივი მცენარეული სუნი მიეკუთვნება იზოპრენის ბლოკებიდან აგებულ ნაერთებს. Squalene, რომელიც პირველად იზოლირებულია ზვიგენის ღვიძლისგან (Squalus სახეობები), შედგება 30 ნახშირბადის ატომისგან: 24 ატომს მთავარ ჯაჭვში და ექვსი ატომისგან მეტალის შემცვლელებში.
სცენა (4). სკვალენის ტრანსფორმაცია სტეროიდული ბირთვის ოთხ რგოლში. ფიგურაში. 21-37 წელში აშკარად ჩანს სკალლენის ჯაჭვის სტრუქტურა, ხოლო სტეროლები - ციკლური. ყველა სტეროლს აქვს ოთხი შედედებული რგოლი, რომლებიც ქმნიან სტეროიდულ ბირთვს და ყველა მათგანი ალკოჰოლია ჰიდროქსილის ჯგუფთან ერთად, C-3 ატომში, შესაბამისად, ინგლისურად ასახელებს სტეროლს. მოქმედების ქვეშ squalene monooxygenase O- სგან ჟანგბადის ატომი ემატება სკალლენის ჯაჭვის ბოლოს 2 და იქმნება ეპოქსიდი. ეს ფერმენტი არის კიდევ ერთი შერეული ფუნქციის ოქსიდაზა (დამატება 21-1), NADPH ამცირებს ჟანგბადის კიდევ ერთ ატომს O- დან 2 ჰ2 ო. პროდუქტის ორმაგი კავშირები სკალლენი-2,3-ეპოქსიდი ისე მოწყობილი, რომ საგრძნობლად თანმიმდევრულმა რეაქციამ შეიძლება გამოიწვიოს სკალლენის ეპოქსიდის ჯაჭვი ციკლურ სტრუქტურაში. ცხოველთა უჯრედებში, ეს ციკლიზაცია იწვევს წარმოქმნას ლანოსტეროლი რომელიც შეიცავს სტეროიდული ბირთვის დამახასიათებელ ოთხ რგოლს. შედეგად, ლანოსტეროლი გარდაიქმნება ქოლესტერინში, დაახლოებით 20 რეაქციის სერიის საშუალებით, რომელიც მოიცავს ზოგიერთი მეტალის ჯგუფის მიგრაციას და სხვათა მოცილებას. ბიოსინთეზის ამ გასაოცარი ბილიკის აღწერა, რომელიც ერთ-ერთი ყველაზე რთულია ცნობილი მათგან, გააკეთეს კონრად ბლოჩმა, თეოდორ ლინენმა, ჯონ კორნორფტმა და ჯორჯ პოპიაკმა 1950-იანი წლების ბოლოს.
სურ. 21-37. ბეჭდის დახურვა წრფივი სკალალენს გადააქცევს შედედებული სტეროიდულ ბირთვად. პირველი ეტაპი კატალიზირდება ოქსიდაზას შერეული ფუნქციით (მონოქსიგენაზაზა), რომლის კოსუბსტრატია N AD PH. პროდუქტი არის ეპოქსიდი, რომელიც შემდეგ ეტაპზე ციკლავს სტეროიდულ ბირთვს. ამ რეაქციების საბოლოო პროდუქტია ცხოველურ უჯრედებში ქოლესტერინი; სხვა ორგანიზმებში წარმოიქმნება სტეროლები, რომლებიც ოდნავ განსხვავდება მისგან.


ქოლესტერინი არის სტეროლი, რომელიც დამახასიათებელია ცხოველური უჯრედებისთვის, მცენარეები, სოკოები და პროთეზები აწარმოებენ სხვა ძალიან მსგავს სტეროლებს.
ისინი იყენებენ იგივე სინთეზის მარშრუტს სკალოლენ-2,3-ეპოქსიდთან, მაგრამ შემდეგ ბილიკები ოდნავ გადახრა და წარმოიქმნება სხვა სტეროლები, მაგალითად, ბევრ მცენარეში სიგმასტოროლი და სოკოების ერგოსტეროლი (ნახ. 21-37).
მაგალითი 21-1 ენერგიის ხარჯები სკალელის სინთეზისთვის
რა არის ენერგიის ხარჯები (გამოხატულია ATP მოლეკულის სახით) ერთი სკალალენის მოლეკულის სინთეზისთვის?
გამოსავალი. აცეტილ- CoA- სგან სკალოლენის სინთეზში, ატფ იხარჯება მხოლოდ იმ ეტაპზე, როდესაც მევალონატი გარდაიქმნება გააქტიურებული იზოფრენი სკალალენის წინამორბედში. სკალინის მოლეკულის ასაშენებლად საჭიროა ექვსი გააქტიურებული იზოფრენის მოლეკულა, ხოლო თითოეული გააქტიურებული მოლეკულის წარმოებისთვის საჭიროა სამი ATP მოლეკულა. საერთო ჯამში, 18 ატფ მოლეკულა იხარჯება ერთი სკალელის მოლეკულის სინთეზზე.
ქოლესტერინის შემცველობა ორგანიზმში
ხერხემლიანებში დიდი რაოდენობით ქოლესტერინი სინთეზირდება ღვიძლში. სინთეზირებული ქოლესტერინის ზოგიერთი ნაწილი მასში შედის ჰეპატოციტების მემბრანებში, მაგრამ იგი ძირითადად ექსპორტზე გადის მისი სამი ფორმადან ერთ-ერთში: ბილიარული (ნაღვლის) ქოლესტერინი, ნაღვლის მჟავები ან ქოლესტერინის ესტერიები. ნაღვლის მჟავები მათი მარილები წარმოადგენს ქოლესტერინის ჰიდროფილური წარმოებულები, რომლებიც ღვიძლში სინთეზირდება და ხელს უწყობს ლიპიდების მონელებას (იხ. ნახ. 17-1). ქოლესტერინის ესტერინები მოქმედებით ღვიძლში ჩამოყალიბდა აცილ-კოა-ქოლესტერინი-აცილტრანსფერაზა (ACAT). ეს ფერმენტი ახდენს ცხიმოვანი მჟავების ნარჩენების გადატანას კოენზიმიდან A ქოლესტერინის ჰიდროქსილის ჯგუფში (ნახ. 21-38) და ამცირებს ქოლესტერინს უფრო ჰიდროფობულ ფორმაში. საიდუმლოებული ლიპოპროტეინების ნაწილაკებში ქოლესტერინის ესტერიები სხვა ქსოვილებში გადადის ქოლესტერინის გამოყენებით ან ინახება ღვიძლში.
სურ. 21-38. ქოლესტერინის ეთერების სინთეზი. ეთერიფიკაცია ქოლესტერინს კიდევ უფრო ჰიდროფობიურ ფორმად აქცევს.

ქოლესტერინი აუცილებელია მზარდი ცხოველური ორგანიზმის ყველა ქსოვილისთვის მემბრანების სინთეზისთვის, ხოლო ზოგიერთ ორგანოში (მაგალითად, თირკმელზედა ჯირკვლები და სასქესო ჯირკვლები) იყენებენ ქოლესტერინს, როგორც სტეროიდული ჰორმონების წინამორბედს (ეს ქვემოთ იქნება განხილული). ქოლესტერინი ასევე წარმოადგენს D ვიტამინის წინამორბედს (იხ. სურათი 10-20, v. 1).
ქოლესტერინი და სხვა ლიპიდები ატარებენ პლაზმურ ლიპოპროტეინებს
ქოლესტერინის და ქოლესტერინის ესტერიები, როგორიცაა ტრიცილგლიცეროლები და ფოსფოლიპიდები, პრაქტიკულად წყალში არხსნან, თუმცა, ისინი უნდა გადავიდნენ ქსოვილისგან, რომელშიც ისინი სინთეზირდნენ იმ ქსოვილებში, სადაც იქნება მათი შენახვა ან მოხმარება. ისინი სისხლს ატარებენ სისხლის ფორმით სისხლის პლაზმის ლიპოპროტეინები - სპეციფიკური გადამზიდავი ცილების მაკრომოლეკულური კომპლექსები (აპოლიპოპროტეინები) ფოსფოლიპიდებით, ქოლესტერინით, ქოლესტერინის ესთერებით და ტრიცილგლიცეროლებით, რომლებიც მოცემულია ამ კომპლექსებში, სხვადასხვა კომბინაციებში.
აპოლიპოპროტეინები (”აპ” თავისთავად ეხება ლიპიდურ პროტეინს) ლიპიდებთან ერთად აერთიანებს ლიპოპროტეინების ნაწილაკების რამდენიმე ფრაქციას - ცენტრში არსებული ჰიდროფობიური ლიპიდების სფერული კომპლექსები და ზედაპირზე ჰიდროფილური ამინომჟავა ჯაჭვები (ნახ. 21-39, ა). ლიპიდების და ცილების სხვადასხვა კომბინაციით, სხვადასხვა სიმკვრივის ნაწილაკები წარმოიქმნება - ქილიმიკრონებიდან მაღალი სიმკვრივის ლიპოპროტეინებამდე. ამ ნაწილაკების განცალკევება შესაძლებელია ულტრაცენტრიფუგირების გზით (ცხრილი 21-1) და ვიზუალურად აღინიშნება ელექტრონული მიკროსკოპის გამოყენებით (სურათი 21-39, ბ). ლიპოპროტეინების თითოეული წილი ასრულებს სპეციფიკურ ფუნქციას, რომელიც განისაზღვრება სინთეზის ადგილის, ლიპიდური შემადგენლობისა და აპოლიპოპროტეინების შემცველობით. ადამიანის სისხლის პლაზმაში მინიმუმ 10 სხვადასხვა აპოლიპოპროტეინი იქნა ნაპოვნი (ცხრილი 21-2), რომლებიც განსხვავდება ზომით, სპეციფიკურ ანტისხეულებთან დაკავშირებული რეაქციები და ლიპოპროტეინების სხვადასხვა კლასებში დამახასიათებელი განაწილება. ეს ცილის კომპონენტები მოქმედებენ, როგორც სასიგნალო ნივთიერებები, რომლებიც მიმართავენ ლიპოპროტეინებს კონკრეტულ ქსოვილებზე ან ააქტიურებენ ფერმენტებს, რომლებიც მოქმედებენ ლიპოპროტეინებზე.
ცხრილი 21-1. ადამიანის პლაზმური ლიპოპროტეინები
შემადგენლობა (მასის ფრაქცია,%)
r = 513,000). LDL- ის ნაწილაკი შეიცავს ქოლესტერინის ეთერების დაახლოებით 1,500 მოლეკულას, ბირთვის გარშემო არის ქოლესტერინის 500 მოლეკულის გარსი, ფოსფოლიპიდების 800 მოლეკულა და აპიბ 100 – ის ერთი მოლეკულა. ბ - ლიპოპროტეინების ოთხი კლასი, რომლებიც ჩანს ელექტრონული მიკროსკოპით (უარყოფითი გამოვლინების შემდეგ). საათის ისრის მიმართულებით, მარცხენა მარცხენა ფიგურიდან დაწყებული: ქილიმიკრონები - 50-დან 200 ნმ დიამეტრით, PL O NP - 28-დან 70 ნმმ-მდე, HDL - 8-დან 11 ნმმ-მდე, ხოლო LDL - 20-დან 55 ნმმამდე. ლიპოპროტეინების თვისებები მოცემულია ცხრილში. 21-2.

ქილომიკრონები, მოხსენიებულია Sec. 17, გადაიტანეთ საკვები ტრიცილიგლიცეროლები ნაწლავიდან სხვა ქსოვილებში. ეს არის ყველაზე დიდი ლიპოპროტეინები, მათ აქვთ ყველაზე დაბალი სიმჭიდროვე და ტრიცილგლიცეროლების ყველაზე მაღალი ნათესავი შინაარსი (იხ. ნახ. 17-2). ქილომიკრონები სინთეზირებულია ეპითელური უჯრედების ER- ში, რომლებიც ნაწლავებს წვრილი ნაწლავის ღრუში აქვთ, შემდეგ გადადიან ლიმფურ სისტემაში და შედიან სისხლძარღვში მარცხენა სუბკლავიური ძარღვში. ქილომიქრონის აპოლიპოპროტეინები შეიცავს apoB-48 (ლიპოპროტეინების ამ კლასისთვის უნიკალური), apoE და apoC-II (ცხრილი 21-2). AroC-II ააქტიურებს ლიპოპროტეინების ლიპაზას ძვლოვანი ქსოვილის, გულის, ჩონჩხის კუნთების და ლაქტაციური სარძევე ჯირკვლების კაპილარებში, რაც უზრუნველყოფს ამ ცხიმმჟავების თავისუფალი ცხიმოვანი მჟავების გადინებას. ამრიგად, ქლომიკრონები საკვების ცხიმოვან მჟავებს გადააქვთ ქსოვილებში, სადაც ისინი მოიხმარენ ან ინახება როგორც საწვავი (ნახ. 21-40). ქილომიკრონის ნარჩენები (ძირითადად განთავისუფლებულია ტრიცილიგლიცეროლებისგან, მაგრამ მაინც შეიცავს ქოლესტერინს, აეე და აპიბ -48), სისხლით გადადიან ღვიძლში. ღვიძლში, რეცეპტორები აკავშირებენ ალოეპს, რომელიც შეიცავს ქლოომიკრონის ნარჩენებს და შუამავლობს მათ შთანთქმის ენდოციტოზით. ჰეპატოციტებში ეს ნარჩენები ათავისუფლებს მათში შემავალ ქოლესტერინს და განადგურებულია ლიზოსომებში.
ცხრილი 21-2. ადამიანის პლაზმური ლიპოპროტეინების აპოლიპოპროტეინები
ფუნქცია (თუ ცნობილია)
ააქტიურებს L CAT- ს, ურთიერთქმედებს ABC გადამზიდავთან
ახდენს L CAT
ააქტიურებს L CAT- ს, ქოლესტერინის ტრანსპორტირებას / კლირენსს
აკავშირებს LDL რეცეპტორს
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
Chylomicrons, VLDL, HDL
იწყებს VLDL და ქილომიკრონის ნარჩენების გაწმენდას
როდესაც საკვები შეიცავს უფრო მეტ ცხიმოვან მჟავებს, ვიდრე ის ამჟამად ნახმარი შეიძლება იყოს საწვავის სახით, ისინი ღვიძლში გადააქვთ ტრიცილგლიცეროლებში, რომლებიც ქმნიან ფრაქციას სპეციფიკურ აპოლიპროტეინებთან ძალიან დაბალი სიმკვრივის ლიპოპროტეინები (VLDL). ღვიძლში გადაჭარბებული ნახშირწყლები შეიძლება გარდაიქმნას ტრიცილიგლიცეროლებში და ექსპორტზე მიიღოთ როგორც VLDL (ნახ. 21-40, ა).ტრიცილგლიცეროლების გარდა, VLDL ფრაქცია შეიცავს გარკვეულ რაოდენობას ქოლესტერინის და ქოლესტერინის ეთერების შემადგენლობაში, ასევე apoB-100, apoC-1, apoC-II, apoC III და apoE (ცხრილი 21-2). ეს ლიპოპროტეინები ასევე გადაჰყავთ სისხლიდან ღვიძლიდან კუნთებამდე და ძვლების ქსოვილში, სადაც, ლიპოპროტეინების ლიპაზას აო-C II- ით გააქტიურების შემდეგ, თავისუფალი ცხიმოვანი მჟავები თავისუფლდება VLDL ფრაქციის ტრიცილგლიცეროლებისგან. ადიოციტები ითვისებენ თავისუფალ ცხიმოვან მჟავებს, ისევ გადააქვთ მათ ტრიცილგლიცეროლებში, რომლებიც ამ უჯრედებში ინახება ლიპიდური ჩანართების სახით (წვეთები), მიოციტები, პირიქით, დაუყოვნებლივ ჟანგავს ცხიმოვან მჟავებს, ენერგიის წარმოქმნის მიზნით. უმეტესად VLDL ნარჩენები ამოღებულია მიმოქცევიდან ჰეპატოციტების მიერ. მათი შეწოვა, მსგავსი chylomicrons- ის შეწოვის შედეგად, შუამავლობენ რეცეპტორების მიერ და დამოკიდებულია VLDL ნარჩენებში apoE- ს არსებობაზე (დამატ. 21-2. აღწერილია apoE და ალცჰეიმერის დაავადებას შორის ურთიერთობა).
სურ. 21-40. ლიპოპროტეინები და ლიპიდების ტრანსპორტირება, და - ლიპიდები ტრანსპორტირდება სისხლის საშუალებით ლიპოპროტეინების სახით, რომლებიც გაერთიანებულია რამდენიმე ფრაქციაში, სხვადასხვა ფუნქციებით და ცილებისა და ლიპიდების სხვადასხვა შემადგენლობით (ტაბ. 21-1, 21-2) და შეესაბამება ამ ფრაქციების სიმკვრივეს. საკვების ლიპიდები აგროვებენ ქილომიკრონებში, მათში შემავალი ტრიცილგლიცეროლების უმეტესობა ლიპოპროტეინების ლიპაზას საშუალებით თავისუფლდება კაპილარებში ადიოპსა და კუნთოვან ქსოვილში. ქილომიკრონის ნარჩენები (ძირითადად შეიცავს ცილებს და ქოლესტერინს) იღებენ ჰეპატოციტებს. ენდოგენური ლიპიდები და ქოლესტერინიდან ღვიძლში მიჰყავთ ცხიმოვან და კუნთოვან ქსოვილებს VLDL ფორმით. VLDL– სგან ლიპიდების გამოთავისუფლება (ზოგიერთ აპოლიპოპროტეინების დაკარგვასთან ერთად) თანდათანობით გარდაქმნის VLDLP- ს LDL- ში, რაც ქოლესტერინს გადააქვს ზედმეტი ღვიძლის ქსოვილებში ან ღვიძლს უბრუნებს მას. ღვიძლის იტაცებს VLDL, LDL და ქილომიკრონების ნარჩენები, რეცეპტორებით გამოწვეული ენდოციტოზით. ზედმეტი ღვიძლის ქსოვილებში ქოლესტერინის ჭარბი ტრანსპორტირება ხდება ღვიძლში, LDL- ის ფორმით. ღვიძლში, ქოლესტერინის ნაწილი გადადის ნაღვლის მარილებში. ბ - სისხლის პლაზმის ნიმუშები, რომლებიც აღებულია შიმშილის (მარცხნივ) და საკვების ჭამის შემდეგ, ცხიმის მაღალი შემცველობით (მარჯვნივ). ცხიმოვანი საკვების ჭამით წარმოქმნილი ქილომიკრონები პლაზმას გარედან ანაზღაურებას აძლევს რძეს.

ტრიცილგლიცეროლების დაკარგვით, VLDL- ის ნაწილი გარდაიქმნება VLDL ნარჩენებად, რომელსაც ასევე უწოდებენ შუალედური სიმკვრივის ლიპოპროტეინებს (VLDL), ტრიცილგლიცეროლების შემდგომი მოცილება იძლევა VLDL- ს. დაბალი სიმკვრივის ლიპოპროტეინები (LDL) (ტაბ. 21-1). LDL ფრაქცია, რომელიც ძალიან მდიდარია ქოლესტერინის და ქოლესტერინის ესთერებით, ასევე შეიცავს apoB-100- ს, ქოლესტერინს გადააქვს ზედმეტი ღვიძლის ქსოვილებში, რომლებიც ატარებენ სპეციფიკურ რეცეპტორებს, რომლებიც აღიარებენ apoB-100- ს მათ პლაზმურ გარსებზე. ეს რეცეპტორები შუამავლობით იღებენ ქოლესტერინის და ქოლესტერინის ეთერების მიღებას (როგორც აღწერილია ქვემოთ).
დამატება 21-2.ApoE ალელები განსაზღვრავენ ალცჰეიმერის დაავადების სიხშირეს
ადამიანის პოპულაციაში, გენური კოდირების აპოლიპოპროტეინების E. ცნობილი გენის სამი ცნობილი ვარიანტია (სამი ალელი), APEE ალელებისა, APOEZ ალელი ყველაზე გავრცელებულია ადამიანებში (დაახლოებით 78%), APOE4 და APOE2 ალელები არის 15 და 7%, შესაბამისად. APOE4 ალელი განსაკუთრებით დამახასიათებელია ალცჰეიმერის დაავადების მქონე ადამიანებისთვის და ეს ურთიერთობა საშუალებას იძლევა დაავადების ალბათობის პროგნოზირება მაღალი ალბათობით. ადამიანები, რომლებმაც მემკვიდრეობით მიიღეს APOE4, აქვთ მაღალი რისკი განვითარების გვიან ალცჰეიმერის დაავადება. APOE4– ის ჰომოზიგოზის მქონე ადამიანები 16 – ჯერ უფრო ხშირად განივითარებენ დაავადებას, ავადმყოფთა საშუალო ასაკი დაახლოებით 70 წლისაა. იმ ადამიანებისთვის, ვინც AROEZ- ს ორი ასლის მემკვიდრეობით მიიღება, პირიქით, ალცჰეიმერის დაავადების საშუალო ასაკი აღემატება 90 წელს.
ApoE4 და ალცჰეიმერის დაავადებას შორის კავშირის მოლეკულური საფუძველი ჯერ კიდევ უცნობია. გარდა ამისა, ჯერჯერობით უცნობია, თუ როგორ შეიძლება გავლენა მოახდინოს apoE4- ს ამილიოიდების საყრდენების ზრდაზე, რაც, სავარაუდოდ, ალცჰეიმერის დაავადების ძირეული მიზეზია (იხ. სურათი 4-31, v. 1). ვარაუდები ფოკუსირდება აეეოს შესაძლო როლზე ნეირონების ციტოქსელის სტრუქტურის სტაბილიზაციაში. ApoE2 და apoEZ ცილები აკავშირებს ცილების უამრავ პროტეინს, რომლებიც უკავშირდება ნეირონების მიკროტუბულებს, ხოლო apoE4 არ არის დაკავშირებული. ამან შეიძლება დააჩქაროს ნეირონების სიკვდილი. რაც არ უნდა აღმოჩნდეს ეს მექანიზმი, ეს დაკვირვებები იძლევა იმის შესაძლებლობას, რომ გააფართოვონ აპოლიპოპროტეინების ბიოლოგიური ფუნქციების შესახებ.
ლიპოპროტეინების მეოთხე ტიპი - მაღალი სიმკვრივის ლიპოპროტეინები (HDL), ეს წილი ღვიძლში და წვრილ ნაწლავში წარმოიქმნება მცირე ცილის მდიდარი ნაწილაკების სახით, რომელიც შეიცავს შედარებით მცირე ქოლესტერინს და ქოლესტერინის ესტრებისგან სრულიად თავისუფალია (ნახ. 21-40). HDL ფრაქცია შეიცავს apoA-I, apoC-I, apoC-II და სხვა აპოლიპოპროტეინებს (ცხრილი 21-2), აგრეთვე ლეციტინი-ქოლესტერინი-აცილტრანსფერაზა (LC AT), რომელიც კატალიზირებს ქოლესტერინის ეთერების წარმოქმნას ლეციტინიდან (ფოსფატიდილქოლინი) და ქოლესტერინიდან (ნახ. 21-41). L CAT ახლად წარმოქმნილი HDL ნაწილაკების ზედაპირზე ქოლიმიკრონის ქოლესტერინის და ფოსფატიდილქოლინის და VLDL ნარჩენების გადაქცევას ქოლესტერინის ესთებად გადააქვს, რომლებიც იწყებენ ბირთვის ფორმირებას, ახლად წარმოქმნილ დისკოიდურ HDL ნაწილაკებს გარდაქმნის სფერულ HDL ნაწილაკებად. ამ ქოლესტერინით მდიდარი ლიპოპროტეინი შემდეგ ღვიძლში უბრუნდება, სადაც ქოლესტერინი „გამოიდევნება“, ამ ქოლესტერინის ზოგიერთი ნაწილი გარდაიქმნება ნაღვლის მარილებში.
სურ. 21-41. რეაქცია, რომელიც დაფიქსირდა ლეციტინ-ქოლესტერინის-აცილტრანსფერაზას (L CAT) მიერ. ეს ფერმენტი წარმოდგენილია HDL ნაწილაკების ზედაპირზე და გააქტიურებულია აპა-1-ით (HDL ფრაქციის კომპონენტი). ქოლესტერინის ესტერიები გროვდება ახლად წარმოქმნილი HDL ნაწილაკების შიგნით, ისინი გადააქვთ სექსუალურ HDL- ში.

HDL ღვიძლში შეიწოვება რეცეპტორებით დაქვემდებარებული ენდოციტოზით, მაგრამ მინიმუმამდე, HDL ქოლესტერინის ზოგიერთ სხვა მექანიზმს სხვა ქსოვილებში გადაეცემა. HDL ნაწილაკებს შეუძლიათ დამაკავშირებელი SR - BI რეცეპტორის ცილები ღვიძლის უჯრედების პლაზმურ მემბრანასა და სტეროიდოგენურ ქსოვილებში, როგორიცაა თირკმელზედა ჯირკვლები. ეს რეცეპტორები არ წარმოადგენენ შუამავლობით ენდოციტოზს, მაგრამ ქოლესტერინის და HDL ფრაქციის სხვა ლიპიდების ნაწილობრივ და სელექციურ გადაცემას უჯრედში. "გაფუჭებული" HDL წილი კვლავ შედის სისხლში, სადაც შედის ლიპიდების ახალი ნაწილი ქილომიკრონების და VLDL ნარჩენებისგან. ამავე HDL- ს შეუძლია აგრეთვე დაიპყროს ქოლესტერინი, რომელიც ინახება ზედმეტი ღვიძლის ქსოვილებში და ღვიძლში გადადის საპირისპირო ქოლესტერინის ტრანსპორტი (სურ. 21-40). საპირისპირო სატრანსპორტო ვარიანტში, შედეგად HDL- ს ურთიერთქმედება ქოლესტერინით მდიდარ უჯრედებში SR-BI რეცეპტორებთან ერთად იწყება ქოლესტერინის პასიური დიფუზია უჯრედის ზედაპირიდან HDL ნაწილაკებში, რაც შემდეგ ქოლესტერინს ღვიძლში გადააქვს. მდიდარი ქოლესტერინის უჯრედში საპირისპირო ტრანსპორტის სხვა ვარიანტში, HDL– ის გაყოფის შემდეგ, apoA-I ურთიერთქმედებს აქტიურ გადამყვანთან, ABC პროტეინთან. ApoA-I (და სავარაუდოდ HDL) შეიწოვება ენდოციტოზი, შემდეგ ხდება სეკრეციის ჩატარება, დატვირთული ქოლესტერინით, რომელიც გადადის ღვიძლში.
პროტეინი ABC1 არის მრავალი წამლის გადამზიდავი ოჯახის დიდი ნაწილის ნაწილი, ამ მატარებლებს ზოგჯერ ეწოდებათ ABC გადამზიდავი, რადგან ყველა მათგანი შეიცავს ATP– დამაკავშირებელ კასეტებს (ATP - სავალდებულო კასეტებს), მათ აქვთ აგრეთვე ორი ტრანსმემბრანული დომენი ექვსი ტრანსმემბრანული ჩაფხუტით (იხ. თავ.). 11, ვ .1). ეს ცილები აქტიურად გადადის მრავალი იონის, ამინომჟავების, ვიტამინების, სტეროიდული ჰორმონების და ნაღვლის მარილების პლაზმურ მემბრანებში. გადამზიდავითა ამ ოჯახის კიდევ ერთი წარმომადგენელი არის CFTR ცილა, რომელიც კისტოზური ფიბროზით არის დაზიანებული (იხ. დამატება 11-3, v. 1).
ქოლესტერინის ესტერი უჯრედში შედის რეცეპტორებით შუამავლობით ენდოციტოზით
სისხლის თითოეულ LDL ნაწილაკს შეიცავს apoB-100, რომელიც აღიარებულია სპეციფიკური ზედაპირული რეცეპტორის ცილებით -LDL რეცეპტორები უჯრედების მემბრანზე, რომლებიც საჭიროა ქოლესტერინის მოპოვებაში. LDL– ის LDL რეცეპტორთან დაკავშირება იწვევს ენდოციტოზს, რის გამოც LDL და მისი რეცეპტორი უჯრედში გადადიან ენდოსომის შიგნით (ნახ. 21-42). საბოლოო ჯამში, ენდოსომა შერწყმულია ლიზოსომასთან, რომელიც შეიცავს ფერმენტებს, რომლებიც ატენიანებენ ქოლესტერინის ეთერებს, ათავისუფლებენ ქოლესტერინს და ცხიმოვან მჟავებს ციტოზოლში. ApoB-100 საწყისი LDL ასევე იშლება, შექმნან ამინომჟავები, რომლებიც გამოიყოფა ციტოზოლში, მაგრამ LDL რეცეპტორი თავს არიდებს დეგრადაციას და ბრუნდება უჯრედის ზედაპირზე, რათა მონაწილეობა მიიღოს ისევ LDL- ის მიღებაში. ApoB-100 ასევე იმყოფება VLDL- ში, მაგრამ მისი რეცეპტორების დამაკავშირებელი დომენი ვერ ახერხებს LDL რეცეპტორთან დაკავშირებას; VLDLP- ის LDL- ში გადაქცევას რეცეპტორების დამაკავშირებელი დომენი აპოB-100- ში აქცევს. სისხლის ქოლესტერინის სატრანსპორტო ეს გზა და მისი რეცეპტორებით შუამავალი ენდოციტოზი სამიზნე ქსოვილებშია შესწავლილი მაიკლ ბრაუნისა და ჯოზეფ გოლდშტაინის მიერ.
მაიკლ ბრაუნი და ჯოზეფ გოლდშტეინი

სურ. 21-42. ქოლესტერინის დახვედრა რეცეპტორებით გამოწვეული ენდოციტოზით.

ქოლესტერინი, რომელიც ამ უჯრედებში შედის ამ გზით, შეიძლება შევიდეს მემბრანებში ან განმეორებით გავაქტიუროთ ACAT– ით (ნახ. 21-38), ლიპიდური წვეთების შიგნით ციტოზოლში შესანახად. როდესაც სისხლში LDL ნაწილში არის საკმარისი ქოლესტერინი, ჭარბი უჯრედშორისი ქოლესტერინის დაგროვება ხელს უშლის მისი სინთეზის მაჩვენებლის შემცირებას.
LDL რეცეპტორი ასევე სავალდებულოა apoE- სთან და მნიშვნელოვან როლს ასრულებს ღვიძლის მიერ ქილიმიკრონების და VLDL ნარჩენების მოპოვებაში. ამასთან, თუ LDL რეცეპტორები მიუწვდომელია (მაგალითად, თაგვის შტამში, რომელიც დაკარგული LDL რეცეპტორის გენის მქონეა), VLDL ნარჩენები და ქილომიკრონები კვლავ შეიწოვება ღვიძლში, თუმცა LDL არ შეიწოვება. ეს მიუთითებს დამხმარე სარეზერვო სისტემის არსებობაზე VLDL და ქილომიკრონის ნარჩენების რეცეპტორებით შუამავლობით ენდოციტოზზე. სარეზერვო რეცეპტორების ერთ-ერთი შემადგენელი არის LRP ცილა (ლიპოპროტეინების რეცეპტორთან დაკავშირებული ცილა), რომელიც დაკავშირებულია ლიპოპროტეინების რეცეპტორებთან, რომელიც აერთებს აფო და სხვა რიგ ლიგანტებს.
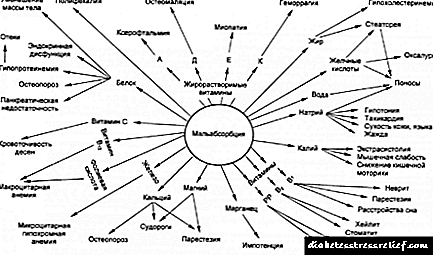
ქოლესტერინის ბიოსინთეზის რეგულირების რამდენიმე დონე
ქოლესტერინის სინთეზი რთული და ენერგიულად ღირებული პროცესია, ამიტომ აშკარაა, რომ ორგანიზმს აქვს სასარგებლო ქოლესტერინის ბიოსინთეზის რეგულირების მექანიზმი, რომელიც ავსებს მის რაოდენობას დამატებით საკვებთან ერთად. ძუძუმწოვრებში, ქოლესტერინის წარმოება რეგულირდება უჯრედშიდა კონცენტრაციით
ქოლესტერინი და ჰორმონები გლუკაგონი და ინსულინი. HMG - CoA– ს გადაქცევას მევალონატორად გადაქცევის ეტაპი (ნახ. 21-34) ზღუდავს სიჩქარეს ქოლესტერინის წარმოქმნის მეტაბოლურ გზაზე (რეგულირების მთავარი წერტილი). ეს რეაქცია კატალიზირებულია HMG - CoA რედუქტაზით. რეგულირება ქოლესტერინის დონის ცვლილებების საპასუხოდ შუამავლობით ხდება ტრანსმისიული რეგულირების ელეგანტური სისტემის მიერ HMG - კოა რედუქტაზას გენური კოდირებისთვის. ეს გენი, 20 – ზე მეტი სხვა გენური კოდური შემცველი ფერმენტის ერთად, რომლებიც მონაწილეობენ ქოლესტერინის და დაუქვემდებარებელი ცხიმოვანი მჟავების შეწოვაში და სინთეზში, აკონტროლებენ ცილების მცირე ოჯახს, რომელსაც ეწოდება ცილები, რომლებიც ურთიერთქმედებენ ცილების წარმოქმნის სტეროლ-მარეგულირებელ ელემენტთან (SREBP, სტეროლის მარეგულირებელი ელემენტი, რომელიც აკავშირებს ცილებს). . სინთეზის შემდეგ, ეს ცილები შეჰყავთ ენდოპლაზმურ რეტიკულუმში. ერთადერთი ხსნადი ამინ-ტერმინალი SREBP დომენი ფუნქციონირებს როგორც ტრანსკრიფციის აქტივატორს Ch- ში აღწერილი მექანიზმების გამოყენებით. 28 (v. 3). ამასთან, ამ დომენს არ აქვს ბირთვსთან წვდომა და ვერ მონაწილეობს გენის გააქტიურებაში, რადგან იგი რჩება SREBP მოლეკულაში. HMG გენის - CoA რედუქტაზას და სხვა გენების ტრანსკრიპციის გასააქტიურებლად ტრანსკრიპციულად აქტიური დომენი გამოყოფილია SREBP– ის დანარჩენ ნაწილში პროტეოლიზური გაყოფით. როდესაც ქოლესტერინი მაღალია, SREBP ცილები არააქტიურია, დაფიქსირებულია ER კომპლექსში სხვა ცილის სახელწოდებით SCAP (SREBP - ცვლის აქტივაციური ცილა) (ნახ. 21-43). ეს არის SCAP, რომელიც აკავშირებს ქოლესტერინს და უამრავ სხვა სტეროლს, რომლებიც მოქმედებენ როგორც სტეროლის სენსორი. როდესაც სტეროლის დონე მაღალია, SCAP - SREBP კომპლექსი ალბათ ურთიერთქმედებს სხვა პროტეინთან, რომელიც მთლიან კომპლექსს ინარჩუნებს ER- ში. როდესაც უჯრედში სტეროლის დონე იკლებს, SCAP- ის კონფორმციური ცვლილება იწვევს შეკავების აქტივობის დაკარგვას, ხოლო SCAP - SREBP კომპლექსი მიგრაციებს ვეზიკების შიგნით გოლგის კომპლექსამდე. გოლგის კომპლექსში, SREBP ცილები ორჯერ იშლება ორი განსხვავებული პროტეაზით, ხოლო მეორე ცვლა ამინ – ტერმინალურ დომეს ათავისუფლებს ციტოზოლში. ეს დომენი გადადის ბირთვზე და ააქტიურებს სამიზნე გენების ტრანსკრიფციას. ამინოფორმირებულ SREBP ცილის დომენს აქვს მცირე ნახევარგამოყოფის პერიოდი და სწრაფად დეგრადაცია ხდება პროტეაზომებით (იხ. სურათი 27-48, ტ. 3). როდესაც სტეროლის დონე საკმარისად მოიმატებს, ამინო ტერმინთან ერთად SR EBP ცილის დომენების პროტეოლიზური გათავისუფლება კვლავ დაბლოკილია, ხოლო არსებული აქტიური დომენების პროტეაზომიური დეგრადაცია იწვევს სამიზნე გენების სწრაფ გამორთვისას.
სურ. 21-43. SR EBP- ის გააქტიურება. SREB P ცილები, რომლებიც ურთიერთქმედებენ სტეროლის რეგულირებულ ელემენტთან (მწვანე ფერით), სინთეზის მიღებისთანავე, შეიტანენ ER- ს, აყალიბებენ კომპლექსს S CAP- ით (წითელი ფერი). (N და C აღნიშნავენ ცილების ამინს და კარბოქსილის ბოლოებს.) S-CAP შეკრულ მდგომარეობაში, SRE BP ცილები არააქტიურია. როდესაც სტეროლის დონე მცირდება, SR EBP-S CAP კომპლექსი მიგრაცია ხდება გოლგის კომპლექსში, ხოლო SR EBP ცილები თანმიმდევრულად იშლება ორი სხვადასხვა პროტეაზას მიერ. განთავისუფლებული ამინომჟავების ტერმინალი SR EBP ცილის დომენი მიგრაცია ხდება ბირთვში, სადაც ის ააქტიურებს სტეროლის რეგულირებადი გენების ტრანსკრიპციას.

ქოლესტერინის სინთეზი ასევე რეგულირდება რამდენიმე სხვა მექანიზმით (ნახ. 21-44). ჰორმონალური კონტროლი შუამავლობით ხდება NM G-CoA რედუქტაზას კოვალენტური მოდიფიკაციით. ეს ფერმენტი არსებობს ფოსფორილირებული (არააქტიური) და დეფოსფორილირებული (აქტიური) ფორმებში. გლუკაგონი ასტიმულირებს ფერმენტის ფოსფორილირებას (ინაქტივაციას), ხოლო ინსულინი ხელს უწყობს დეფოსფორილირებას, ფერმენტის გააქტიურებას და ხელს უწყობს ქოლესტერინის სინთეზს. ქოლესტერინის მაღალი უჯრედული კონცენტრაცია ააქტიურებს ASAT- ს, რაც ზრდის ქოლესტერინის ეთერფიკაციას დეპონირებისთვის. დაბოლოს, ფიჭური ქოლესტერინის მაღალი დონე აფერხებს გენის ტრანსკრიფციას, რომელიც კოდს ატარებს LDL რეცეპტორს, ამცირებს ამ რეცეპტორის წარმოებას და, შესაბამისად, სისხლიდან ქოლესტერინის მიღებას.
სურ. 21-44. ქოლესტერინის დონის რეგულირება უზრუნველყოფს ბალანსს საკვებიდან ქოლესტერინის სინთეზსა და მის შთანთქმას შორის. გლუკაგონი ხელს უწყობს NM G -CoA რედუქტაზას ფოსფორილირებას (ინაქტივაციას), ინსულინი ხელს უწყობს დეფოსფორილირებას (გააქტიურება). X - დაუდგენელი ქოლესტერინის მეტაბოლიტები, რომლებიც ასტიმულირებენ NM G -CoA რედუქტაზას პროტეოლიზას.

არარეგულირებული ქოლესტერინი შეიძლება გამოიწვიოს სერიოზულ დაავადებას ადამიანებში. როდესაც საკვებიდან მიღებული სინთეზირებული ქოლესტერინის და ქოლესტერინის ჯამური რაოდენობა აღემატება მემბრანის შეკრებისთვის საჭირო რაოდენობას, ნაღვლის მარილებისა და სტეროიდების სინთეზს, სისხლძარღვებში ქოლესტერინის პათოლოგიური დაგროვებები (ათეროსკლეროზული დაფები) შეიძლება აღმოჩნდეს, რაც იწვევს მათ ბლოკირებას (ათეროსკლეროზი). ინდუსტრიულ ქვეყნებში ეს არის გულის უკმარისობა კორონარული არტერიების ობსტრუქციის გამო, რაც სიკვდილიანობის მთავარი მიზეზია. ათეროსკლეროზის განვითარება დაკავშირებულია სისხლის ქოლესტერინის მაღალ დონესთან და განსაკუთრებით მაღალი ქოლესტერინის შემცველობით, რომელსაც ტოლერანტული LDL ფრაქცია აქვს;
მემკვიდრეობითი ჰიპერქოლესტერინემიით (გენეტიკური დეფექტი), სისხლში ქოლესტერინის დონე ძალიან მაღალია - მძიმე ათეროსკლეროზი ვითარდება ამ ადამიანებში უკვე ბავშვობაში. დეფექტური LDL რეცეპტორის გამო, ხდება LDL ქოლესტერინის არასაკმარისი მიღება-რეცეპტორებით დატვირთვა. შედეგად, ქოლესტერინი არ იხსნება სისხლისგან, ის გროვდება და ხელს უწყობს ათეროსკლეროზული დაფების წარმოქმნას. ენდოგენური ქოლესტერინის სინთეზი გრძელდება, სისხლში გადაჭარბებული ქოლესტერინის მიუხედავად, რადგან უჯრედული ქოლესტერინი ვერ შედის უჯრედში უჯრედული სინთეზის მოსაწესრიგებლად (ნახ. 21 -44).მემკვიდრეობითი ჰიპერქოლესტერინემიით დაავადებულ პაციენტებთან და შრატში მომატებულ ქოლესტერინთან დაკავშირებული სხვა დაავადებების სამკურნალოდ, სტატინის კლასები გამოიყენება. ზოგი მათგანი ბუნებრივი წყაროებიდან მიიღება, ზოგი კი - ფარმაცევტული ინდუსტრიის სინთეზირებაში. სტატინები მსგავსია mevalonate- ს (დამატება 21-3) და NMS-CoA რედუქტაზის კონკურენტული ინჰიბიტორია.
დამატება 21-3. მედიკამენტი. ლიპიდური ჰიპოთეზა და სტატინების შექმნა
გულის კორონარული დაავადება (CHD) განვითარებული ქვეყნებში სიკვდილიანობის მთავარი მიზეზია. კორონარული არტერიების შევიწროება, რომლებიც გულს სისხლს ატარებენ, ხდება ცხიმოვანი დეპოზიტების წარმოქმნის შედეგად, რომელსაც ეწოდება ათეროსკლეროზული დაფები; ეს დაფები შეიცავს ქოლესტერინს, ფიბრილულ ცილებს, კალციუმს, თრომბოციტების შედედებას და უჯრედულ ფრაგმენტებს. XX საუკუნეში. აქტიური დებატები მიმდინარეობდა არტერიული ობსტრუქციის (ათეროსკლეროზის) და სისხლის ქოლესტერინის ურთიერთკავშირის შესახებ. ამ დისკუსიებმა და ამ მიმართულებით აქტიურმა კვლევებმა განაპირობა ეფექტური წამლების შექმნა, რომელიც ამცირებს ქოლესტერინს.
1913 წელს, ნ.ნ. ანიჩკოვმა, ცნობილმა რუსმა მეცნიერმა და ექსპერიმენტული პათოლოგიის დარგის სპეციალობამ, გამოაქვეყნა ნაშრომი, რომელშიც მან აჩვენა, რომ ქოლესტერინით მდიდარი საკვებით კვებამ კურდღელი აზიანებს სისხლძარღვებს, რომლებიც წააგავს ათეროსკლეროზულ პლაცებს მოხუცთა გემებში. ანიჩკოვმა თავისი კვლევა რამდენიმე ათეული წლის განმავლობაში ჩაატარა და შედეგები გამოაქვეყნა ცნობილ დასავლურ ჟურნალებში. სამწუხაროდ, მისი მონაცემები არ გახდა საფუძველი ადამიანებში ათეროსკლეროზის განვითარების მოდელის შესაქმნელად, რადგან ამ დროს ჭარბობდა ჰიპოთეზა, რომ ეს დაავადება დაბერების ბუნებრივი შედეგია და მისი პრევენცია შეუძლებელია. თუმცა, მტკიცებულება თანდათანობით გროვდებოდა ურთიერთობა შრატის ქოლესტერინსა და ათეროსკლეროზის (ლიპიდური ჰიპოთეზის) განვითარებასა და 1960-იან წლებში. ზოგი მკვლევარმა პირდაპირ თქვა, რომ ამ დაავადებით მკურნალობა შესაძლებელია მედიკამენტებით. ამასთან, საპირისპირო თვალსაზრისი არსებობდა 1984 წლამდე გამოქვეყნებული შედეგების შესახებ, თუ რა შედეგი გამოიღო ქოლესტერინის როლი, რომელიც ჩატარდა აშშ-ს ჯანმრთელობის ეროვნული ინსტიტუტის მიერ (კორონარული პირველადი პრევენციის ცდა). გამოვლინდა მიოკარდიუმის ინფარქტის სიხშირის სტატისტიკურად მნიშვნელოვანი დაქვეითება და ინსულტის დროს სისხლის ქოლესტერინის დაქვეითება. ამ გამოკვლევაში, ქოლესტერინი, ანიონის გაცვლის ფისი, რომელიც აკავშირებს ნაღვლის მჟავებს, გამოიყენებოდა ქოლესტერინის შესამცირებლად. შედეგებმა ხელი შეუწყო ახალი, უფრო ძლიერი თერაპიული მედიკამენტების ძიებას. უნდა ითქვას, რომ სამეცნიერო სამყაროში, ლიპიდური ჰიპოთეზის მოქმედების შესახებ ეჭვები მთლიანად გაქრა მხოლოდ 80-იანი წლების ბოლოს - სტატინების მოსვლასთან ერთად - 90-იანი წლების დასაწყისში.
პირველი სტატინი აღმოაჩინეს აკირა ენდოს მიერ ტოკიოში, სანკიოში. ენდო გამოქვეყნდა თავისი ნაშრომი 1976 წელს, თუმცა იგი რამდენიმე წლის განმავლობაში ქოლესტერინის მეტაბოლიზმის პრობლემას შეეხო. 1971 წელს მან თქვა, რომ ქოლესტერინის სინთეზის ინჰიბიტორები შეიძლება შეიცავდეს იმ დროს ანტიბიოტიკების სოკოს მწარმოებლებს. რამდენიმეწლიანი ინტენსიური მუშაობისთვის მან გაანალიზა სხვადასხვა სოკოს 6000-ზე მეტი კულტურა, სანამ დადებით შედეგამდე არ მივიდა. შედეგად ნაერთს კომპაქტინი ეწოდებოდა. ამ ნივთიერებამ შეამცირა ქოლესტერინი ძაღლებში და მაიმუნებში. ამ კვლევებმა მიქაელ ბრაუნისა და ჯოზეფ გოლდშტაინის ყურადღება მიიპყრო ტეხასის უნივერსიტეტის სამხრეთ-დასავლეთის სამედიცინო სკოლის წარმომადგენლებმა. ბრაუნმა და გოლდშტეინმა ენდოსთან ერთად დაიწყეს ერთობლივი გამოკვლევა და დაადასტურეს მისი მონაცემები. პირველი კლინიკური კვლევების მთავარ წარმატებებში ფარმაცევტული კომპანიები მონაწილეობდნენ ამ ახალი მედიკამენტების შემუშავებაში. მერკში გუნდმა ალფრედ ალბერტსი და როი ვაგელოს ხელმძღვანელობით წამოიწყეს სოკოს კულტურების ახალი სკრინინგი და, საერთო ჯამში 18 კულტურის ანალიზის შედეგად, აღმოაჩინეს კიდევ ერთი აქტიური პრეპარატი. ახალ ნივთიერებას ლავასტატინი ეწოდება. თუმცა, ამავე დროს, გავრცელებული იყო მოსაზრება, რომ ძაღლებზე კომპაქტინის მაღალი დოზების მიღება იწვევს კიბოს განვითარებას და ახალი სტატინების ძიებას 1980-იან წლებში. შეჩერებულია. ამასთან, ამ დროისთვის აშკარა იყო სტატინების გამოყენების უპირატესობა ოჯახური ჰიპერქოლესტერინემიის მქონე პაციენტებთან მკურნალობისთვის. საერთაშორისო ექსპერტებთან და სურსათისა და წამლის ადმინისტრაციასთან (FDA, აშშ) მრავალი კონსულტაციის შემდეგ, მერკმა დაიწყო ლოვასტატინის შემუშავება. მომდევნო ორი ათწლეულის განმავლობაში ჩატარებულმა მასშტაბურმა კვლევებმა არ გამოავლინა ლოვასტატინის და ახალი თაობის წამლების კანცეროგენული მოქმედება, რომელიც გამოჩნდა მის შემდეგ.
სურ. 1. სტატინები NM G-CoA რედუქტაზას ინჰიბიტორია. მეგალონატის სტრუქტურის შედარება და ოთხი ფარმაცევტული პროდუქტი (სტატინები), რომლებიც ახდენენ NM G -CoA რედუქტაზას მოქმედებას,

სტატინები შეაჩეროს HMG - CoA მოქმედება - რედუქტაზა, მივალონატის სტრუქტურის მიმიქცევა და ამით დაბლოკოს ქოლესტერინის სინთეზი. პაციენტებში, რომლებსაც ჰიპერქოლესტერინემია იწვევს LDL რეცეპტორების გენის ერთ ეგზემპლარში დეფექტის დროს, ლოვასტატინის მიღების დროს, ქოლესტერინის დონე მცირდება 30% -ით. პრეპარატი კიდევ უფრო ეფექტურია სპეციალურ ფისებთან ერთად, რომლებიც აკავშირებენ ნაღვლის მჟავებს და ხელს უშლიან ნაწლავებიდან მათ შებრუნებულ შეწოვას.
ამჟამად, სტატინები ყველაზე ხშირად გამოიყენება სისხლის პლაზმის ქოლესტერინის შესამცირებლად. ნებისმიერი მედიკამენტების მიღებისას, ჩნდება კითხვა მათი არასასურველი გვერდითი ეფექტების შესახებ. ამასთან, სტატინების შემთხვევაში, მრავალი გვერდითი მოვლენა, პირიქით, დადებითია. ამ მედიკამენტებს შეუძლიათ სისხლის ნაკადის სტიმულირება, უკვე არსებული ათეროსკლეროზული დაფების დაფიქსირება (ისე, რომ ისინი არ გაირღვეს სისხლძარღვების კედლებიდან და არ ჩაერიონ სისხლის ნაკადს), შეაჩერონ თრომბოციტების აგრეგაცია, ასევე შეასუსტონ სისხლძარღვების კედლებში ანთებითი პროცესები. პაციენტებში, რომლებიც პირველად იღებენ სტატინს, ეს ეფექტები ვლინდება ქოლესტერინის დონის დაქვეითებამდეც, და შესაძლოა ეს დაკავშირებული იყოს იზოფრენოიდული სინთეზის ინჰიბირებასთან. რა თქმა უნდა, სტატინების ყველა გვერდითი ეფექტი არ არის სასარგებლო. ზოგიერთ პაციენტში (ჩვეულებრივ, მათ შორის, რომლებიც იღებენ სტატინს სხვა პრეპარატებთან ერთად, რომლებიც ამცირებენ ქოლესტერინს), შეიძლება მოხდეს კუნთების ტკივილი და კუნთების სისუსტე, ზოგჯერ კი საკმაოდ ძლიერი ფორმით. რეგისტრირებულია სტატინების სხვა საკმაოდ მრავალი გვერდითი მოვლენები, რომლებიც, საბედნიეროდ, იშვიათად გვხვდება. პაციენტების უმრავლესობაში, სტატინების მიღებამ შეიძლება შეაჩეროს გულ-სისხლძარღვთა დაავადებების განვითარება. სხვა სამკურნალო საშუალებების მსგავსად, სტატინები უნდა გამოიყენოთ მხოლოდ ექიმის რეკომენდაციით.

HDL ქოლესტერინის მემკვიდრეობითი არარსებობის შემთხვევაში, ქოლესტერინის დონე ძალიან დაბალია, ტანგიერის დაავადებით, ქოლესტერინი პრაქტიკულად არ არის განსაზღვრული. ორივე გენეტიკური დარღვევა გამოწვეულია ABC1 ცილაში მუტაციებით. HDL თავისუფალი ქოლესტერინის ფრაქცია ვერ შეიპყრობს ქოლესტერინს ABC1 დეფიციტური უჯრედებისგან, ხოლო ქოლესტერინის გამოდევნილი უჯრედები სწრაფად ამოღებულია სისხლიდან და განადგურებულია. HDL და Tangier დაავადების მემკვიდრეობითი არარსებობა ძალზე იშვიათია (მთელს მსოფლიოში ცნობილია ტანგიერის დაავადების 100-ზე მეტი ოჯახი), მაგრამ ეს დაავადებები აჩვენებს ABC1 ცილის როლს HDL პლაზმის დონის რეგულირებაში. იმის გამო, რომ დაბალი პლაზმური HDL დონეები უკავშირდება კორონარული არტერიის დაზიანების მაღალ მაჩვენებელს, ABC1 ცილა შეიძლება იყოს სასარგებლო სამიზნე წამლებისთვის, რომლებიც შექმნილია HDL დონის რეგულირებისთვის. ■
სტეროიდული ჰორმონები იქმნება ქოლესტერინის გვერდითი ჯაჭვის გაყოფით და მისი დაჟანგვით.
ადამიანი იღებს ყველა მის სტეროიდულ ჰორმონს ქოლესტერინისგან (ნახ. 21-45). სტეროიდული ჰორმონების ორი კლასი სინთეზირებულია თირკმელზედა ჯირკვლის ქერქში: მინერალკორტიკოიდები,რომლებიც არეგულირებენ არაორგანული იონების შეწოვას (Na +, C ლ - და HC O) 3 -) თირკმელებში, და გლუკოკორტიკოიდები, რომლებიც გლუკოგენოგენეზის რეგულირებას უწყობს ხელს და ამცირებს ანთებით პასუხს. სქესის ჰორმონები იწარმოება ქალისა და მამაკაცის რეპროდუქციულ უჯრედებში და პლაცენტაში. მათ შორის პროგესტერონი რომელიც არეგულირებს ქალის რეპროდუქციულ ციკლს, ანდროგენები (მაგ. ტესტოსტერონი) და ესტროგენები (ესტრადიოლი), რომლებიც გავლენას ახდენენ მამაკაცებში და ქალებში საშუალო სექსუალური მახასიათებლების განვითარებაზე. სტეროიდულ ჰორმონებს აქვთ ეფექტი ძალიან დაბალ კონცენტრაციებზე და, შესაბამისად, სინთეზირებულია შედარებით მცირე რაოდენობით. ნაღვლის მარილებთან შედარებით, შედარებით მცირე ქოლესტერინი მოიხმარს სტეროიდული ჰორმონების წარმოებას.

სურ. 21-45. ზოგიერთი სტეროიდული ჰორმონი იქმნება ქოლესტერინისგან. ამ ნაერთების ზოგიერთი სტრუქტურა ნაჩვენებია ნახ. 10-19, ვ. 1.

სტეროიდული ჰორმონების სინთეზი მოითხოვს ნახშირბადის რამდენიმე ან ყველა ატომის მოცილებას ქოლესტერინის C-17 D- ბეჭდის "გვერდით ჯაჭვში". გვერდითი ჯაჭვის მოცილება ხდება სტეროიდოგენული ქსოვილების მიტოქონდრიაში. მოცილების პროცესი შედგება გვერდითი ჯაჭვის ორი მიმდებარე ნახშირბადის ატომის ჰიდროქსილაციისგან (C-20 და C-22), შემდეგ კი მათ შორის კავშირის გაწყვეტით (ნახ. 21-46). სხვადასხვა ჰორმონების ფორმირებაში ასევე შედის ჟანგბადის ატომების შეყვანა. სტეროიდული ბიოსინთეზის დროს ჰიდროქსილირების და დაჟანგვის ყველა რეაქცია კატალიზირდება შერეული ფუნქციის ოქსიდაზებით (დამატება 21-1), რომლებიც იყენებენ NА D PH, O 2 და მიტოქონდრიული ციტოქრომ P-450.
სურ. 21-46. გვერდითი ჯაჭვის ცვლა სტეროიდული ჰორმონების სინთეზში. ამ ოქსიდაზა სისტემაში შერეული ფუნქციით, რომელიც ჟანგავს მიმდებარე ნახშირბადის ატომებს, ციტოქრომ P-450 მოქმედებს როგორც ელექტრონული გადამზიდავი. პროცესში ასევე მონაწილეობენ ელექტრონებითმყოფი ცილები, ადრენოდოქსინი და ადრენოდოქსინის რედუქტაზა. გვერდითი ჯაჭვის გაყოფის ეს სისტემა აღმოაჩინეს თირკმელზედა ჯირკვლის ქერქის მიტოქონდრიაში, სადაც ხდება სტეროიდების აქტიური წარმოება. პრევენენოლონი არის ყველა სხვა სტეროიდული ჰორმონის წინამორბედი (ნახ. 21-45).

ქოლესტერინის ბიოსინთეზის შუამავლები ჩართულია სხვა მეტაბოლურ გზებში.
გარდა ქოლესტერინის ბიოსინთეზის შუალედური როლისა, იზოპენტენილის პიროფოსფატი მოქმედებს როგორც წინამორბედი უზარმაზარი ბიომოლეკულების სინთეზში, რომლებიც ასრულებენ სხვადასხვა ბიოლოგიურ ფუნქციებს (ნახ. 21-47). ესენია ვიტამინები A, E და K, მცენარეთა პიგმენტები, როგორიცაა კაროტინი და ქლოროფილის ფიტოლის ჯაჭვი, ბუნებრივი რეზინი, მრავალი ეთერზეთი (მაგალითად, ლიმონის ზეთის სურნელოვანი ბაზა, ევკალიპტი, მუშკი), მწერების არასრულწლოვანი ჰორმონი, რომელიც არეგულირებს მეტამორფოზის, დოლიჩოლების და ა.შ. ლიპიდური ხსნარის გადამტანები წარმოადგენენ პოლისაქარიდების, ubiquinone და plastoquinone- ის კომპლექსურ სინთეზს - ელექტრონული გადამტანები მიტოქონდრიასა და ქლოროპლასტებში. ყველა ეს მოლეკულა სტრუქტურაში არის იზოპრენოიდები. ბუნებაში აღმოჩენილია 20 000-ზე მეტი განსხვავებული იზოფრენოიდი, ყოველწლიურად ასობით ახალი გვხვდება.
სურ. 21-47. იზოპრენოიდების ბიოსინთეზის საერთო სურათი. აქ წარმოდგენილი საბოლოო პროდუქციის უმეტესობის სტრუქტურები მოცემულია თავში. 10 (v. 1).

პრენილაცია (იზოპრენოიდების კოვალენტური მიმაგრება, იხ. ნახ. 27-35) არის საერთო მექანიზმი, რომლითაც ცილები აძლიერებენ ძუძუმწოვრების უჯრედების მემბრანების შიდა ზედაპირზე (იხ. ნახ. 11-14). ზოგიერთ ცილში, შეკრული ლიპიდი წარმოდგენილია 15 ნახშირბადოვანი ფარნეზილის ჯგუფით, ზოგიერთში კი 20-ნახშირბადოვანი გერანილის გერანილის ჯგუფი. ლიპიდების ეს ორი ტიპი სხვადასხვა ფერმენტებს აერთებს. შესაძლებელია, რომ პრონილირების რეაქციამ პროტეინები მიმართოს სხვადასხვა მემბრანებზე, იმისდა მიხედვით, თუ რომელ ლიპიდს თან ერთვის. ცილოვანი ცილინის მიღება კიდევ ერთი მნიშვნელოვანი როლია იზოფრენის წარმოებულებისთვის - ქოლესტერინის მეტაბოლური გზის მონაწილეებისთვის.
სექცია 21.4 ქოლესტერინის, სტეროიდების და იზოპრენოიდების ბიოსინთეზი
■ ქოლესტერინი წარმოიქმნება აცეტილ-CoA- სგან, რთული რეაქციის თანმიმდევრობით, intermediates მეშვეობით, როგორიცაა β-ჰიდროქსი-β-მეთილგლუტარილ-CoA, მევალონატი, ორი გააქტიურებული იზოფრენი დიმეთილალილ პიროფოსფატი და იზოპენტენილ პიროფოსფატი. იზოპრენის ერთეულების კონდენსაცია იძლევა ციკლურ სკვალენს, რომელიც ციკლავს შედედებული რგოლების სისტემის და სტეროიდული გვერდითი ჯაჭვის ფორმირებას.
Of ქოლესტერინის სინთეზი ექვემდებარება ჰორმონალურ კონტროლს და, გარდა ამისა, ინჰიბირდება უჯრედშორისი ქოლესტერინის კონცენტრაციების ზრდა, რაც ხდება კოვალენტური მოდიფიკაციით და ტრანსკრიპციის რეგულირების გზით.
■ ქოლესტერინი და ქოლესტერინის ესტერიები სისხლს ატარებენ, როგორც პლაზმურ ლიპოპროტეინებს. VLDL ფრაქცია გადადის ქოლესტერინის, ქოლესტერინის ესტრებისა და ტრიცილიგლიცეროლებისგან ღვიძლის სხვა ქსოვილებში, სადაც ტრიცილიგლიცეროლები იშლება ლიპოპროტეინების ლიპაზით და VLDL გარდაიქმნება LDL. ქოლესტერინის და ქოლესტერინის ესთერებში გამდიდრებული LDL ფრაქცია ირიბად იპყრობს რეცეპტორებს ენდოციტოზით, ხოლო LDL- ში B-100 აპოლიპოპროტეინი აღიარებულია პლაზმური მემბრანის რეცეპტორებით. HDL ამოიღეთ ქოლესტერინი სისხლიდან, გადააქვთ ღვიძლში. კვების პირობებმა ან ქოლესტერინის მეტაბოლიზმში გენეტიკურმა დეფექტებმა შეიძლება გამოიწვიოს ათეროსკლეროზი და მიოკარდიუმის ინფარქტი.
■ სტეროიდული ჰორმონები (გლუკოკორტიკოიდები, მინერალოკორტიკოიდები და სქესის ჰორმონები) წარმოიქმნება ქოლესტერინიდან, გვერდითი ჯაჭვის შეცვლით და ჟანგბადის ატომების შემოღებით რგოლის სტეროიდულ სისტემაში. მრავალი სხვა იზოფრენოიდული ნაერთი წარმოიქმნება მეილოონატისგან, ქოლესტერინთან ერთად იზოპენტენილის პიროფოსფატისა და დიმეთილალურადილ პიროფოსფატის კონდენსაციის შედეგად.
Of გარკვეული ცილების პრენილაცია მათ უბიძგებს უჯრედულ გარსებთან დამაკავშირებელ ადგილებს და მნიშვნელოვანია მათი ბიოლოგიური მოქმედებისთვის.
კითხვა 48. მაღალი ცხიმოვანი მჟავების მეტაბოლიზმის რეგულირება (β- დაჟანგვა და ბიოსინთეზი). მალონილის CoA- ს სინთეზი. აცეტილ CoA კარბოქსილაზა, მისი საქმიანობის რეგულირება. აცილის Co-a- ს ტრანსპორტირება მიტოქონდრიის შიდა გარსის მეშვეობით.
მთავარი
მოიხმარენ ფენილალანინის რაოდენობას
2 გზით:
ჩართულია
ციყვი
მონაცვლეობით
ტიროზინში.
შემობრუნება
ფენილალანინი, პირველ რიგში, ტიროზინამდე
საჭიროა ჭარბი ამოღება
ფენილალანინი, რადგან მაღალი კონცენტრაციაა
ის ტოქსიკურია უჯრედებისთვის. განათლება
ტიროზინს ნამდვილად არ აქვს მნიშვნელობა
ამ ამინომჟავის ნაკლებობის გამო
უჯრედებში პრაქტიკულად არ ხდება.
მთავარი
იწყება ფენილალანინის მეტაბოლიზმი
მისი ჰიდროქსილირებით (ნახ. 9-29), ინ
შედეგად ტიროზინი.
ეს რეაქცია კატალიზირებულია სპეციფიკის მიერ
monooxy-nase - ფენილალანინის ჰიდრა (ზსილაზა,
რომელიც ემსახურება როგორც პროდიუსერს
ტეტრაჰიდრობიოპტერინი (N4BP).
ფერმენტების მოქმედება ასევე დამოკიდებულია
Fe2– ის არსებობა.
ინ
ღვიძლში, ძირითადად, დაჩქარებული მობილიზაცია ხდება
გლიკოგენი (იხ. ნაწილი 7). თუმც აქციები
ღვიძლში გლიკოგენი განიდევნება
18-24 საათის განმავლობაში უზმოზე. ძირითადი წყარო
გლუკოზა, როგორც აქციები ამოიწურა
გლიკოგენი ხდება გლუკონოგენეზი,
რომლის დაჩქარება იწყება
სურ.
11-29. მეტაბოლური ძირითადი ცვლილებები
ენერგია, როდესაც შთამნთქმელი იცვლება
პოსტაბსორბციული მდგომარეობა. CT
- კეტონის სხეულები, FA - ცხიმოვანი მჟავები.
4-6 სთ
ბოლო ჭამის შემდეგ. სუბსტრატები
გლიცეროლი გამოიყენება გლუკოზის სინთეზისთვის,
ამინომჟავები და ლაქტატი. მაღლა
გლუკაგონის კონცენტრაციის სინთეზის მაჩვენებელი
ცხიმოვანი მჟავების შემცირება გამო
ფოსფორილირება და ინაქტივაცია
აცეტილ CoA კარბოქსილაზა და სიჩქარე
p- დაჟანგვა იზრდება. თუმცა,
ღვიძლის ცხიმის მომატება
მჟავები, რომლებიც ტრანსპორტირდება
ცხიმის საცობიდან. ჩამოყალიბდა აცეტილ-CoA
ცხიმოვანი მჟავების დაჟანგვისას გამოიყენება
ღვიძლში, კეტონის ორგანოების სინთეზისთვის.
ინ
ცხიმოვანი ქსოვილი მზარდი კონცენტრაციით
გლუკაგონმა შეამცირა სინთეზის მაჩვენებელი
TAG და ლიპოლიზის სტიმულირება ხდება. სტიმულირება
ლიპოლიზი - გააქტიურების შედეგი
ჰორმონის მგრძნობიარე TAG ლიპაზა
adipocytes გლუკაგონის გავლენის ქვეშ.
ცხიმოვანი მჟავები მნიშვნელოვანი ხდება
ენერგიის წყაროები ღვიძლში, კუნთებში და
ცხიმოვანი ქსოვილი.
ასე რომ
ამრიგად, პოსტაბსორბციის პერიოდში
შენარჩუნებულია სისხლში გლუკოზის კონცენტრაცია
80-100 მგ / დლ-ზე და ცხიმოვანი დონის დონეზე
მჟავები და კეტონის სხეულები იზრდება.
შაქარი
დიაბეტი არის დაავადება, რომელიც ხდება
აბსოლუტური ან ნათესავიდან გამომდინარე
ინსულინის დეფიციტი.
ა.
შაქრის ძირითადი კლინიკური ფორმები
დიაბეტი
შესაბამისად
მსოფლიო ორგანიზაცია
ჯანდაცვის დიაბეტი
კლასიფიცირდება განსხვავებების მიხედვით
გენეტიკური ფაქტორები და კლინიკური
ორი ძირითადი ფორმა: დიაბეტი
ტიპი I - ინსულინდამოკიდებულნი (IDDM) და დიაბეტი
ტიპი II - ინსულინის დამოუკიდებელი (NIDDM).
რეგულირება
zhk- ის სინთეზი. მარეგულირებელი ფერმენტი
LCD– ის სინთეზი - აცეტილ CoA კარბოქსილაზა.
ეს ფერმენტი რეგულირდება რამდენიმეით
გზები
გააქტიურება / დაშლა
ფერმენტის ქვედაქვეშა კომპლექსები. ინ
აცეტილ CoA კარბოქსილაზის არააქტიური ფორმა
წარმოადგენს ცალკეულ კომპლექსებს,
რომელთაგან თითოეული 4 ქვეგანაგია.
ფერმენტის აქტივატორი არის ციტრატი. ეს ასტიმულირებს
შედეგად კომპლექსების კომბინაცია
ამით იზრდება ფერმენტის აქტივობა
. ინჰიბიტორი-პალმიტოლი-CoA. ის დარეკავს
რთული დისოციაცია და შემცირება
ფერმენტის მოქმედება.
ფოსფორილირება / დეფოსფორილიაცია
აცეტილ CoA კარბოქსილაზა. ინ
პოსტაბსორბციის მდგომარეობა ან მასში
ფიზიკური მუშაობა გლუკაგონიზირებულია
ადრენალინი ადენილატ ციკლაზას მეშვეობით
სისტემა გააქტიურებულია პროკინაზას A და
ქვედაქვეშა ფოსფორილირების სტიმულირება
აცეტილ CoA კარბოქსილაზა. ფოსფორილირებული
ფერმენტი არააქტიურია და ცხიმოვანი სინთეზი
მჟავები ჩერდება.
შთამნთქმელი
ინსულინი ააქტიურებს ფოსფატაზას,
და აცეტილ-CoA კარბოქსილაზა გადადის
დეფოსფორილირებული სახელმწიფო. შემდეგ
ხდება ციტრატის გავლენის ქვეშ
ფერმენტის პრომერების პოლიმერიზაცია, და
ის აქტიური ხდება. გააქტიურების გარდა
ფერმენტი, ციტრატი ასრულებს სხვა
ფუნქციონირებს LCD სინთეზში. შთამნთქმელი
პერიოდი ღვიძლის უჯრედების მიტოქონდრიაში
გროვდება ციტრატი, რომელშიც
აცილის ნარჩენი ტრანსპორტირდება
ციტოზოლი.
რეგულირება
β- დაჟანგვის მაჩვენებლები.
ბ- დაჟანგვა-მეტაბოლური გზა,
მტკიცედ არის დაკავშირებული CPE- ს და ზოგადად
კატაბოლიზმის გზები. ამიტომ მისი სიჩქარე
რეგულირდება უჯრედის მოთხოვნილებით
ენერგია ATP / ADP და NADH / NAD კოეფიციენტებით, ასევე CPE და რეაქციის სიხშირით
კატაბოლიზმის საერთო გზა. სიჩქარე
ქსოვილებში β- დაჟანგვა დამოკიდებულია ხელმისაწვდომობაზე
სუბსტრატი, ე.ი.
ცხიმოვანი რაოდენობით
მჟავები შედის მიტოქონდრიაში.
ცხიმოვანი მჟავების უფასო კონცენტრაცია
სისხლში აქტივაციის დროს იზრდება
ლიპოლიზი ცხიმოვან ქსოვილში, უზმოზე
გლუკაგონის გავლენის ქვეშ და ფიზიკური დროს
იმუშავეთ ადრენალინის გავლენის ქვეშ. ამათში
ცხიმოვანი მჟავები ხდება
ენერგიის უპირატესი წყარო
კუნთებისა და ღვიძლისთვის, შედეგად
β- დაჟანგვა წარმოიქმნება NADH და აცეტილ-CoA ინჰიბიციით
პირუვატის დეჰიდროგენაზას კომპლექსი.
პირუვეტის ფორმირების ტრანსფორმაცია
გლუკოზადან აცეტილ-CoA შენელდება.
შუალედური მეტაბოლიტები გროვდება
გლიკოლიზი და, კერძოდ, გლუკოზა-6-ფოსფატი.
გლუკოზა-6-ფოსფატი აფერხებს ჰექსოკინაზას
და, შესაბამისად, იმედგაცრუებულია
გლუკოზის გამოყენება ამ პროცესში
გლიკოლიზი. ამრიგად, უპირატესი
LCD– ის, როგორც მთავარი წყაროს გამოყენება
კუნთების ქსოვილში და ღვიძლში ენერგია
დაზოგავს გლუკოზას ნერვული ქსოვილისთვის და
სისხლის წითელი უჯრედები.
ბ – დაჟანგვის მაჩვენებელიც
დამოკიდებულია ფერმენტის მოქმედებაზე
კარნიტინის აცილტრანსფერაზები ი.
ღვიძლში, ამ ფერმენტის ინჰიბირება ხდება.
malonyl CoA, წარმოქმნილი ნივთიერება
LCD- ის ბიოსინთეზით. შთანთქმის პერიოდში
გლიკოლიზი გააქტიურებულია ღვიძლში და
იზრდება აცეტილ-CoA წარმოქმნა
პირუვატიდან. პირველი სინთეზის რეაქცია
აცეტილ-CoA- ს LCD კონვერტაცია მალონილ-CoA- ში.
მალონილ-CoA აფერხებს LCD– ის ბ – დაჟანგვას,
რომელიც შეიძლება გამოყენებულ იქნას სინთეზისთვის
ცხიმი.
განათლება
malonyl-CoA აცეტილ-CoA- რეგულირებისგან
რეაქცია ბიოსინთეზში LCD პირველი რეაქცია
აცეტილ-CoA- ს სინთეზის LCD კონვერტირება
malonyl CoA. კატალიტიკური ფერმენტი
ეს რეაქცია (აცეტილ კოა კარბოქსილაზა),
მიეკუთვნება ლიგაზების კლასს. ის შეიცავს
კოვალალურად შეკრული ბიოტინი. პირველში
co2 კოვალენტური რეაქციის ეტაპები
აკავშირებს ბიოტინს ენერგიის გამო
ATP, მეორე ეტაპზე COO- გადაცემულია
აცეტილ-CoA- ზე შექმნას მალონილ-CoA.
აცეტილ CoA კარბოქსილაზას ფერმენტის მოქმედება
განსაზღვრავს ყველა შემდგომში სიჩქარეს
სინთეზური რეაქციები ს.ს.
ციტრატი ააქტიურებს ფერმენტს ციტოზოლში
აცეტილ CoA კარბოქსილაზა. მალონიილის CoA in
თავის მხრივ ხელს უშლის უფრო მაღალი გადაცემას
ცხიმოვანი მჟავები ციტოზოლიდან მატრიქსამდე
მიტოქონდრიების შემაფერხებელი მოქმედება
გარე აცეტილის CoA: კარნიტინის აცილტრანსფერაზა,
რითაც გამორთეთ უფრო მაღალი დაჟანგვა
ცხიმოვანი მჟავები.
აცეტილ-CoA ოქსიალოაცილატი
HS-CoA ციტრატი

HSCOA ATP Citrate → Acetyl-CoA ADP Pi Oxaloacetate
აცეტილ-CoA
ციტოპლაზმში მოქმედებს როგორც საწყისი სუბსტრატი
LCD- ის სინთეზისთვის და oxaloacetate- სთვის
ციტოზოლი გადის ტრანსფორმაციებს
რის შედეგადაც წარმოიქმნება პირუვატი.
ქოლესტერინის ბიოსინთეზი
ქოლესტერინის ბიოსინთეზი ხდება ენდოპლაზმურ რეტიკულუმში. მოლეკულაში ყველა ნახშირბადის ატომის წყაროა აცეტილ-SCoA, რომელიც აქ მოდის მიტოქონდრიაში ციტრატში, ისევე როგორც ცხიმოვანი მჟავების სინთეზში. ქოლესტერინის ბიოსინთეზი მოიხმარს 18 ატფ მოლეკულას და 13 NADPH მოლეკულს.
ქოლესტერინის ფორმირება ხდება 30-ზე მეტ რეაქციაში, რომელთა დაჯგუფება შესაძლებელია რამდენიმე ეტაპზე.
1. მეგალონური მჟავის სინთეზი.
პირველი ორი სინთეზის რეაქცია ემთხვევა კეტოგენეზის რეაქციებს, მაგრამ 3-ჰიდროქსი-3-მეთილგლუტარილ-ScoA სინთეზის შემდეგ, ფერმენტი შემოდის ჰიდროქსიმეთილ-გლუტარილ-ScoA რედუქტაზა (HMG-SCOA რედუქტაზა), წარმოქმნის მივალონური მჟავა.
 |