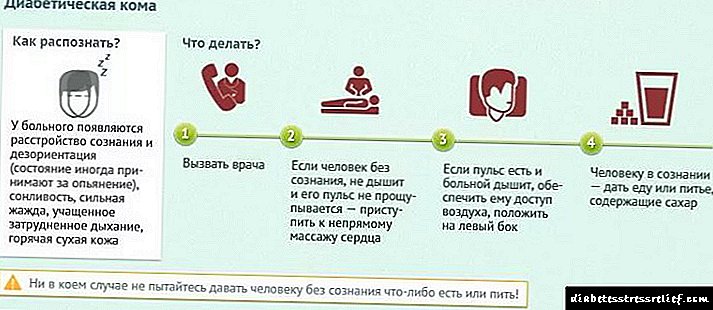
გამოყენების ინსტრუქცია "Invokany", შემადგენლობა, პრეპარატის ანალოგები, ფასი და მიმოხილვები
ტიპი 2 დიაბეტი მოზრდილებში, დიეტასთან და ვარჯიშთან ერთად, გლიკემიური კონტროლის ხარისხის გასაუმჯობესებლად:
- მონოთერაპია
- როგორც კომბინირებული თერაპიის ნაწილი სხვა ჰიპოგლიკემიურ საშუალებებთან, ინსულინის ჩათვლით.
ზრდასრული ტიპის 2 დიაბეტით დაავადებულთათვის ინვოქანას რეკომენდებული დოზა იქნება 100 მგ ან 300 მგ დღეში ერთხელ.
თუ კანაგლიფლოზინი გამოიყენება როგორც სხვა მედიკამენტების დანამატი (ინსულინის გარდა ან მისი წარმოება აძლიერებს წამლებს), მაშინ შესაძლებელია უფრო დაბალი დოზები, ჰიპოგლიკემიის ალბათობის შესამცირებლად.
ზოგიერთ შემთხვევაში, შეიძლება არსებობდეს არასასურველი რეაქციების განვითარების ძლიერი ალბათობა წამლის Invocana– ს მიმართ. ისინი შეიძლება ასოცირდებოდეს ინტრავასკულური მოცულობის შემცირებას. ეს შეიძლება იყოს პოსტულარული თავბრუსხვევა, არტერიული ან ორთოსტატული ჰიპოტენზია.
ჩვენ ვსაუბრობთ ისეთ პაციენტებზე, რომლებიც:
- დამატებით მიიღო დიურეზულები,
- აქვს პრობლემები თირკმელების ზომიერ ფუნქციონირებასთან,
- ისინი ასაკში არიან (75 წელზე მეტი ასაკის).
ამის გათვალისწინებით, ამ კატეგორიის პაციენტებმა უნდა მიიღონ კანაფლიფლოცინი დოზით 100 მგ ერთხელ საუზმეზე ადრე.
იმ პაციენტებს, რომლებიც განიცდიან ჰიპოვოლემიის ნიშანს, მკურნალობენ კანაგლიფლოზინითერაპიის დაწყებამდე ამ მდგომარეობის კორექტირების გათვალისწინებით.
პაციენტებს, რომლებიც იღებენ 100 მლ ინოკანას წამალს და კარგად მოითმენს მას, ასევე საჭიროა სისხლში შაქრის დამატებითი კონტროლი, გადაეცემა კანაგლიფლოზინის 300 მგ-მდე დოზა.
დოზის გადაჭარბება
სიმპტომები კანაგლიფლოზინის დოზის გადაჭარბების შესახებ ცნობილი არ არის. კანაფლიფლოზინის ერთჯერადი დოზა, რომელიც ჯანმრთელ პირებში 1600 მგ-ს მიაღწევდა, ხოლო 300 მგ ორჯერ დღეში 12 კვირის განმავლობაში, 2 ტიპის დიაბეტის მქონე პაციენტებში, ზოგადად კარგად იყო მოქცეული.
მკურნალობა პრეპარატის დოზის გადაჭარბების შემთხვევაში აუცილებელია ჩატარდეს ჩვეულებრივი დამხმარე ზომები, მაგალითად, კუჭ-ნაწლავის ტრაქტიდან არ შეიწოვება ნივთიერების ამოღება, კლინიკური დაკვირვების ჩატარება და ჩატარდეს შემანარჩუნებელი მკურნალობა პაციენტის კლინიკური მდგომარეობის გათვალისწინებით. კანაგლიფლოზინი პრაქტიკულად არ გამოიყოფა 4-საათიანი დიალიზის დროს. კანაგლიფლოზინის გამოყოფა არ არის საჭირო პერიტონეალური დიალიზის საშუალებით.
უკუჩვენებები:
პრეპარატი Invokana არ შეგიძლიათ გამოიყენოთ ასეთ პირობებში:
- ჰიპერმგრძნობელობა კანაგლიფლოზინის ან სხვა ნივთიერების მიმართ, რომელიც გამოყენებული იქნა როგორც დამხმარე,
- ტიპი 1 დიაბეტი
- დიაბეტური კეტოაციდოზი,
- თირკმლის მწვავე უკმარისობა
- ღვიძლის უკმარისობა
- ორსულობა და ლაქტაცია,
- 18 წლამდე ბავშვები.
ორსულობისა და ძუძუთი კვების პერიოდში არ ჩატარებულა ორგანიზმის რეაქცია სხეულის რეაქციაზე Invocana. ცხოველების ექსპერიმენტებში არ აღმოჩნდა, რომ კანაგლიფლოზინს აქვს არაპირდაპირი ან პირდაპირი ტოქსიკური ეფექტი რეპროდუქციული სისტემის მხრივ.
თუმცა, ყოველ შემთხვევაში, ქალის მიერ წამლის გამოყენება მათი ცხოვრების ამ პერიოდის განმავლობაში მკაცრად არ არის რეკომენდებული, რადგან მთავარ აქტიურ ინგრედიენტს შეუძლია შეაღწიოს დედის რძეში და ასეთი მკურნალობის ფასი შეიძლება გაუმართლებელი იყოს.
ურთიერთქმედება სხვა მედიკამენტებთან და ალკოჰოლთან:
კანაგლიფლოზინმა არ გამოიწვია CYP450 სისტემის იზოენზიების გამოხატვა (3A4, 2C9, 2C19, 2B6 და 1A2) ადამიანის ჰეპატოციტების კულტურაში. მან ასევე არ შეუშალა ციტოქრომ P450- ის (1A2, 2A6, 2C19, 2D6 ან 2E1) იზოენზიმები და სუსტი ინჰიბიცია CYP2B6, CYP2C8, CYP2C9, CYP3A4, ლაბორატორიული კვლევების თანახმად, ადამიანის ღვიძლის მიკროზომების გამოყენებით. ინ ვიტრო კვლევებმა აჩვენა, რომ კანაგლიფლოზინი არის ნარკოტიკების მეტაბოლიზებული ფერმენტების სუბსტრატი UGT1A9 და UGT2B4 და P- გლიკოპროტეინების (P-gp) და MRP2 წამლის გადამზიდავი ნივთიერებები. კანაგლიფლოზინი არის P-gp სუსტი ინჰიბიტორი.
კანაგლიფლოზინი გადის მინიმალურ ჟანგვითი მეტაბოლიზმში. ამრიგად, სხვა სამკურნალო საშუალებების კლინიკურად მნიშვნელოვანი მოქმედება კანაგლიფლოცინის ფარმაკოკინეტიკაზე ციტოქრომ P450 სისტემის მეშვეობით ნაკლებად სავარაუდოა.
შემადგენლობა და თვისებები:
Invocan- ის 1 ტაბლეტში, ფილმი დაფარული 100 მგ, შეიცავს:
აქტიური ნივთიერება: 102.0 მგ კანაგლიფლოცინის ჰემიჰიდრატი, რაც ეკვივალენტურია კანაგლიფლოზინის 100.0 მგ-მდე. აღმდგენი საშუალებები (ბირთვი): მიკროკრისტალური ცელულოზა 39.26 მგ, უწყლო ლაქტოზა 39.26 მგ, კროსკარმელოზა ნატრიუმი 12.00 მგ, ჰიპერლოზა 6.00 მგ, მაგნიუმის სტეარატი 1.48 მგ. აღმდგენი საშუალებები (ჭურვი): Opadry II საღებავი 85F92209 ყვითელი (ნაწილობრივ შემადგენლობაში შედის პოლივინილის სპირტი, ნაწილობრივ ჰიდროლიზებული, 40.00%, ტიტანის დიოქსიდი 24.25%, მაკროგოლი 3350 20.20%, ტალკი 14.80%, რკინის ოქსიდის ყვითელი ( E172) 0.75%) - 8.00 მგ.
Invocan– ის 1 ტაბლეტში, ფილმი დაფარული 300 მგ, შეიცავს:
306.0 მგ კანაგლიფლოცინის ჰემიჰიდრატი, რაც ეკვივალენტურია კანაგლიფლოზინის 300.0 მგ-მდე. აღმგზნები (ბირთვი): მიკროკრისტალური ცელულოზა 117.78 მგ, უწყლო ლაქტოზა 117,78 მგ, კროსკარმელოზა ნატრიუმი 36.00 მგ, ჰიპეროზოლი 18.00 მგ, მაგნიუმის სტეარატი 4.44 მგ. აღმდგენი საშუალებები (ჭურვი): Opadray II 85F18422 თეთრი საღებავი (პოლივინილის სპირტი, ნაწილობრივ ჰიდროლიზირებული, 40.00% ტიტანის დიოქსიდი 25.00%, მაკროგოლი 3350 20.20%, ტალკი 14.80%) - 18.00 მგ. .
ფილმი დაფარული ტაბლეტები.
ინკოკანას პრეპარატი აუცილებელია მოზრდილებში ტიპის 2 დიაბეტის სამკურნალოდ. თერაპია მოიცავს მკაცრ დიეტასთან კომბინაციას, ისევე როგორც რეგულარულ ვარჯიშს.
გლიკემია მნიშვნელოვნად გაუმჯობესდება მონოთერაპიის წყალობით, ისევე როგორც სხვა ჰიპოგლიკემიური აგენტებით კომბინირებული მკურნალობის დროს.
გამოშვების ფორმა
წამალი გადანაწილებულია ტაბლეტების სახით, რომლებიც დაფარულია ყვითელი ან თეთრი ფილმის საფარით. კაფსულის ფორმის აბები განსხვავდება დოზირების მიხედვით.
თუ პროდუქტი შეიცავს 100 მგ აქტიურ ნივთიერებას, ტაბლეტი ყვითელია. ერთის მხრივ არის წარწერა "CFZ", მეორეს მხრივ დოზირება მითითებულია. თუ წამალი შეიცავს 300 მგ კანაგლიფლოზინს, მაშინ კაფსულები ფერის თეთრია. გრავირება ხდება იმავე პრინციპების შესაბამისად.

ფარმაკოდინამიკა და ფარმაკოკინეტიკა
აქტიური ნივთიერება არის Na- დამოკიდებული გლუკოზის გადამზიდავის ინჰიბიტორი. ამ ქონების გამო, მცირდება რაფინირებული შაქრის რეაბსორბცია და მცირდება შაქრისთვის თირკმლის ბარიერი. შედეგად, შარდში ნახშირწყლების ექსკრეცია იზრდება. გამოკვლევის დროს, 300 მგ პრეპარატის მიღებამდე, პაციენტებში, რომლებსაც აქვთ ტიპი 2 დიაბეტი, აღენიშნებათ შეწოვის შეანელებამ შაქრის ნაწლავებში და გლუკოზის დაქვეითება თირკმლისა და ექსტრეანალური მექანიზმების გამო.
მნიშვნელოვანია! პრეპარატის ეფექტურობა არ არის დამოკიდებული საკვების მიღებაზე.
პრეპარატი ხასიათდება აქტიური შეწოვით. გამოყენების შემდეგ 60 წუთის განმავლობაში აღინიშნება აქტიური კომპონენტის მაქსიმალური კონცენტრაცია. ნივთიერების ნახევარი ამოღების დრო სჭირდება დაახლოებით 10.5 საათს, თუ იღებთ 100 მგ ინვოქანას და 13 საათს, თუ იღებთ 300 მგ. პრეპარატის ბიოშეღწევადობა შეადგენს 65%. აღინიშნება პროტეინებთან აქტიური კავშირიც - 99%.
ჩვენებები და უკუჩვენებები
პრეპარატის გამოყენების პირდაპირი მითითებაა ინსულინდამოკიდებული შაქრიანი დიაბეტი. გამოყენება შესაძლებელია მონოთერაპიის სახით ვარჯიშთან და სპეციალურ დიეტასთან ერთად. ასევე, მედიცინა ინიშნება კომბინირებულ თერაპიაში სხვა ანტიდიაბეტურ საშუალებებთან.
გამოყენების უკუჩვენებები მოიცავს პრეპარატის კომპონენტების შეუწყნარებლობას. ასევე არ არის რეკომენდებული პრეპარატის გამოყენება თირკმელებისა და ღვიძლის უკმარისობის, გულის ქრონიკული დაავადებების დროს. ბავშვები და მოზარდები, ტიპი 1 შაქრიანი დიაბეტი, ორსულობა და ლაქტაცია ასევე არის ამ პრეპარატის უარის თქმის მიზეზები.

გვერდითი მოვლენები
არასასურველი ეფექტები ხდება იშვიათად - შემთხვევათა 2%. ყველაზე გავრცელებულ გვერდითი ეფექტს შეიძლება ეწოდოს პოლიურია - შარდის ექსკრეციის მოცულობის მატება. ასევე, პაციენტს შეიძლება უჩიოდეს გულისრევა, ძლიერი წყურვილი, ყაბზობა.

ნაკლებად გავრცელებულია სასქესო სისტემის სისტემის ანთებითი დაავადებები. ჩვეულებრივ აღინიშნება ბალანიტი, ვულვოვაგინიტი, ბალანოპოსტიტი, ცისტიტი. გამონაყარი კანზე, ჰიპოტენზია, იშვიათად გვხვდება.
დოზირება და დოზის გადაჭარბება
მკურნალობა მიზანშეწონილია დაიწყოს 100 მგ დოზით დღეში. თუ პაციენტი გაივლის თერაპიას გვერდითი ეფექტების გარეშე, მაგრამ სისხლში შაქრის კონცენტრაციის სრული კონტროლი არ მიიღწევა, დოზა შეიძლება გაიზარდოს 300 მილიგრამამდე დღეში. თუ Invokana გამოიყენება როგორც კომბინირებული მკურნალობის კომპონენტი, აუცილებელია თანმდევი პრეპარატების დოზის კორექცია.
დოზის გადაჭარბება უკიდურესად იშვიათია. ტიპი 2 დიაბეტის მქონე პაციენტები ყოველდღიურად ტოლერანებენ 600 მგ. თუ მედიკამენტების მიღების დროს პაციენტის მდგომარეობის გაუარესება მაინც მოხდა, მაშინ საჭიროა კუჭის ამორეცხვა და სორბენტების გამოყენება.
ურთიერთქმედება
შარდმჟავებთან ერთად მიღებისას, მათი ეფექტის ზრდა აღინიშნება. ეს გამოიხატება დიურეზის მომატებით, რომელსაც შეუძლია დეჰიდრატაციის პროვოცირება. ასევე, სხვა ჰიპოგლიკემიური აგენტებით წამლების გამოყენება ზრდის სისხლში შაქრის გადაჭარბებული დაქვეითების რისკს.
ყურადღება! ჰიპოგლიკემიის თავიდან ასაცილებლად, რეკომენდებულია გლუკოზის მუდმივი მონიტორინგი და დოზის კორექცია.
ინვოქანა ურთიერთქმედებს ფერმენტ ინდუქტორებთან (ბარბიტურატები, რიფამპიცინი, ფენიტოინი, კარბამაზეპინი, რიტონავირი). ეს ვლინდება ჰიპოგლიკემიური ეფექტის დაქვეითებით.
ფარმაკოკინეტიკის ცვლილებები არ აღინიშნება ორალური კონტრაცეპტივების, მეტფორმინის ერთად გამოყენების დროს. აქედან გამომდინარე, ამ თანხების გაერთიანება შესაძლებელია.
აქტიურ ნივთიერებაში მხოლოდ ერთი წამლის ანალოგია განვითარებული - ვოკანამეტი. ფარმაკოლოგიური მოქმედების შემცვლელი ნივთიერებები განიხილება შედარებითი აღწერილობაში.
| წამლის სახელი | აქტიური კომპონენტი | მაქსიმალური თერაპიული ეფექტი (საათები) | მწარმოებელი |
| ვოკანამეტი | კანაგლიფლოზინი, მეტფორმინი | 24 | Janssen Ortho LLS / Janssen-Silag S.p.A. for "Johnson & Johnson, LLC", აშშ / იტალია / რუსეთი |
| ვიქტოზა | ლირაგლიტიდი | 24 | ნოვო ნორდისკი, A / T, დანია |
| ჟარდენსი | empagliflozin | 24 | Beringer Ingelheim Pharma GmbH & Co. კგ, გერმანია |
ეს წამლები არანაკლებ ეფექტურია. მაგრამ მედიკამენტის დამოუკიდებელი შერჩევა კატეგორიულად არ არის რეკომენდებული.
პაციენტების მოსაზრებები, რომლებმაც გამოიყენეს წამალი.
პრეპარატი "ინკოკანა" მირჩიეს ენდოკრინოლოგის მიერ. ფასი მაღალია, მაგრამ ეფექტი შესამჩნევია. სისხლში შაქარი ნორმალურ ზედა ზღვარზე და არ იზრდება, რაც ძალიან კარგია!
კონსტანტინე, 47 წლის
რამოდენიმე წლის წინ გამიკეთეს ტიპი 2 დიაბეტი. მას მკურნალობდნენ მეტფორმინი, მაგრამ არ უშველა. შემდეგ ექიმმა დანიშნა ინკოკანკა. შაქრის დონის სტაბილიზაცია მოხდა და თავს ბევრად უკეთ ვგრძნობ.
დიდი ხანია დიაბეტი მაქვს. ბევრ წამალს ვცდილობდი, ზოგს საერთოდ არ უშველა. ახლახან ექიმმა გირჩიათ წამალი ”ინკოკანა”. თავიდან ფასი შემეშინდა, მაგრამ მისი ყიდვა გადაწყვიტა. შედეგი დიდი ხნის განმავლობაში არ მოვიდა. შაქარი პრაქტიკულად არ იზრდება, ის კარგად გრძნობს თავს.
ვალერია, 63 წლის
პრეპარატის ღირებულება რუბლით, რუსეთის ფედერაციის ზოგიერთ ქალაქში:
| ქალაქი | ინკოკანა 100 მგ N30
| ინკოკანა 300 მგ N30 |
| მოსკოვი | 2653 | 4444 |
| ჩელიაბინსკი | 2537,90 | 4226,10 |
| სანქტ-პეტერბურგი | 3010 | 4699 |
| ულიანოვსკი | 2511,70 | 4211,10 |
| ტომსკი | 2477 | 4185 |
| სარატოვი | 2531 | 4278 |
წამლის ფასი მაღალია. ეს მრავალი პაციენტისთვის ხდება მედიკამენტებთან მკურნალობაზე უარის თქმის მიზეზი.
დასკვნა
იმისდა მიუხედავად, რომ ინკოკანა არის ძვირადღირებული პრეპარატი, ის დიაბეტით დაავადებულთა წარმატებას წარმოადგენს. ეფექტურობა და მცირე რაოდენობის გვერდითი მოვლენები პრეპარატის მნიშვნელოვანი უპირატესობაა.
დიაბეტს სწორი მკურნალობა ჭირდება. წამლის თერაპიის, კვების და ვარჯიშის კომპლექსი კარგ ჰიპოგლიკემიურ ეფექტს ახდენს. რეგულარული მედიკამენტები და ენდოკრინოლოგის ყველა რეცეპტის დაცვა წარმატების გასაღებია ნებისმიერი პაციენტისთვის. დამატებითი ინფორმაცია შეგიძლიათ გაიგოთ ამ ვიდეოდან:
დოზირების ფორმა:
300 მგ ფილმში დაფარული ტაბლეტი შეიცავს:
306.0 მგ კანაგლიფლოცინის ჰემიჰიდრატი, რაც ეკვივალენტურია კანაგლიფლოზინის 300.0 მგ-მდე.
აღმძვრელები (ძირითადი): მიკროკრისტალური ცელულოზა 117,78 მგ, უწყლო ლაქტოზა 117,78 მგ, კროსკარმელოზა ნატრიუმი 36.00 მგ, ჰიპეროზოლი 18.00 მგ, მაგნიუმის სტეარატი 4.44 მგ.
აღმძვრელები (ჭურვი): Opadray II 85F18422 თეთრი საღებავი (პოლივინილის სპირტი, ნაწილობრივ ჰიდროლიზირებული, 40.00% ტიტანის დიოქსიდი 25.00%, მაკროგოლი 3350 20.20%, ტალკი 14.80%) - 18.00 მგ.
აღწერა:
დოზირება 100 მგ: კაფსულის ფორმის ტაბლეტები *, დაფარულია ყვითელი ფირის დაფარვით, ერთ მხარეს ამოტვიფრული CFZ და მეორეზე 100-ით.
* ჯვარედინი მონაკვეთზე, ტაბლეტის ბირთვი თეთრი ან თითქმის თეთრია.
დოზირება 300 მგ: კაფსულის ფორმის ტაბლეტები, დაფარული თეთრი ან თითქმის თეთრი ფერის ფირის მემბრანით, ერთ მხარეს ამოტვიფრული CFZ და მეორეზე 300.
ფარმაკოლოგიური თვისებები:
ფარმაკოდინამიკური ეფექტები
კლინიკურ კვლევებში, კანაგლიფლოზინის ერთჯერადი და მრავალჯერადი პერორალური მიღების შემდეგ, 2 ტიპის დიაბეტის მქონე პაციენტებში, გლუკოზის თირკმლის ბარიერი შემცირდა დოზით დამოკიდებულებით, ასევე გაიზარდა თირკმელებით გლუკოზის გამოყოფა. თირკმელზედა ჯირკვლის თირკმლის საწყისი ზღვრის საწყისი ღირებულება იყო დაახლოებით 13 მმოლ / ლ, გლუკოზის 24-საათიანი საშუალო თირკმლის ბარიერის მაქსიმალური ვარდნა დაფიქსირდა კანაგლიფლოზინის გამოყენებასთან ერთად დოზით 300 მგ დღეში ერთხელ და მერყეობდა 4-დან 5 მმოლ / ლ-მდე, რაც მიუთითებს დაბალი რისკის არსებობაზე. ჰიპოგლიკემია მკურნალობის დროს. I ფაზის I კვლევებში პაციენტებში, რომლებსაც აქვთ დიაბეტი ტიპი 2, რომლებმაც მიიღეს კანაგლიფლოზინი 100 მგ დოზით ან 300 მგ დოზით, გლუკოზის თირკმლის თიხის შემცირებამ გამოიწვია თირკმელების მიერ გლუკოზის ექსკრეციის ზრდა 77-119 გ / დღეში, თირკმელების მიერ გლუკოზის ექსკრეციის დაქვეითებამ 308 – დან 476 კკალ / დღეში. თირკმლის თირკმლის ზღვარის დაქვეითება და თირკმელებით გლუკოზის ექსკრეციის მომატება გაგრძელდა 26 კვირიანი მკურნალობის პერიოდში პაციენტებში, რომლებსაც აქვთ ტიპი 2 შაქრიანი დიაბეტი. შარდის ყოველდღიური მოცულობის ზომიერი მატება იყო (შეწოვა
კანაგლიფლოზინის საშუალო აბსოლუტური ბიოშეღწევადობა დაახლოებით 65% -ს შეადგენს. ცხიმებით მდიდარი საკვების ჭამა არ იმოქმედებს კანაგლიფლოცინის ფარმაკოკინეტიკაზე, ამიტომ კანაგლიფლოზინის მიღება შესაძლებელია საკვებთან ერთად. ამასთან, კანაგლიფლოზინის შესაძლებლობის გათვალისწინებით, შესაძლებელია შემცირდეს მშობიარობის შემდგომი გლიკემიის ზრდა ნაწლავებში გლუკოზის ნელი შეწოვის გამო, რეკომენდებულია კანაგლიფლოზინის მიღება პირველი ჭამის წინ.
განაწილება
ჯანმრთელ ადამიანებში ერთჯერადი ინტრავენური ინფუზიის შემდეგ კანაგლიფლოზინის განაწილების საშუალო მოცულობა წონაში, იყო 83,5 ლ, რაც მიუთითებს ფართო განაწილებაზე ქსოვილებში. კანაგლიფლოზინი მეტწილად ასოცირდება პლაზმის ცილებთან (99%), ძირითადად ალბუმინთან. ცილებთან კომუნიკაცია არ არის დამოკიდებული კანაგლიფლოცინის კონცენტრაციაში პლაზმაში. პლაზმის ცილებთან ურთიერთობა მნიშვნელოვნად არ ცვლის თირკმლის ან ღვიძლის უკმარისობის მქონე პაციენტებში.
მეტაბოლიზმი
O- გლუკურონიდაცია არის კანაგლიფლოცინის მეტაბოლიზმის მთავარი გზა. გლუკურონიდაცია ძირითადად ხდება UGT1A9- ისა და UGT2B4- მდე ორი არააქტიური O- გლუკურონიდის მეტაბოლიტის მონაწილეობით. კანაგლიფლოზინის AUC– ის ზრდა (26% და 18%) დაფიქსირდა UGT1A9 * 3 და UGT2B4 * 2 ალელების პაციენტებში, შესაბამისად. ამ ეფექტს მოსალოდნელი არ აქვს კლინიკური მნიშვნელობა. ადამიანის სხეულში კანაგლიფლოზინის CYP3A4- ის შუამავალი (ოქსიდაციური) მეტაბოლიზმი მინიმალურია (დაახლოებით 7%).
მეცხოველეობა
14C-canagliflozin ერთჯერადი დოზის მიღებისას, პერორალურად ჯანმრთელი მოხალისეების მიერ, მიღებული რადიოაქტიური დოზის 41,5%, 7.0% და 3.2% გამოვლინდა განავალში, როგორც კანაგლიფლოზინი, ჰიდროქსილირებული მეტაბოლიტი და O- გლუკურონიდი მეტაბოლიტი, შესაბამისად.კანაგლიფლოზინის ენტეროჰეპტიკური მიმოქცევა უმნიშვნელო იყო.
ადმინისტრირებული რადიოაქტიური დოზის დაახლოებით 33% აღმოჩნდა შარდში, ძირითადად, როგორც O- გლუკურონიდის მეტაბოლიტები (30.5%). დოზის 1% -ზე ნაკლები გამოიყოფა თირკმელების მიერ უცვლელი კანაგლიფლოზინის გზით. თირკმლის კლირენსი კანაგლიფლოზინის გამოყენებით 100 მგ და 300 მგ დოზებში 1.30-დან 1.55 მლ / წთ-მდე.
კანაგლიფლოზინი გულისხმობს დაბალი კლირენსის მქონე მედიკამენტებს, საშუალო სისტემური კლირენსი შეადგენს დაახლოებით 192 მლ / წთ ჯანმრთელ პირებში, ინტრავენური შეყვანის შემდეგ.
სპეციალური პაციენტების ჯგუფები
თირკმელების ფუნქციის დარღვევის მქონე პაციენტებს
კანაგლიფლოზინის Cmax გაიზარდა ზომიერად 13%, 29% და 29% პაციენტებში, რომლებსაც აქვთ თირკმლის ფუნქციის დარღვევა, ზომიერი და მძიმე, შესაბამისად, მაგრამ არა ჰემოდიალიზის მქონე პაციენტებში. ჯანმრთელ მოხალისეებთან შედარებით, კანაფლიფლოცინის შრატში AUC გაიზარდა დაახლოებით 17%, 63% და 50% თირკმელების მსუბუქი, ზომიერი და მძიმე უკმარისობის მქონე პაციენტებში, მაგრამ იგივე იყო ჯანმრთელ მოხალისეებში და თირკმელების ქრონიკული უკმარისობის დასასრულის ეტაპზე (პაციენტებში). )
კანაგლიფლოცინის დიალიზის გზით გაყვანა მინიმალური იყო.
პაციენტები ღვიძლის ფუნქციის დარღვევით
კანაგლიფლოზინის გამოყენებისას 300 მგ დოზით გამოყენების შემდეგ, ერთხელ შედარებით პაციენტებში, რომლებსაც აქვთ ღვიძლის ნორმალური ფუნქცია, დაქვეითებული აქვთ A ხარისხის დაქვეითებული ღვიძლის ფუნქცია ბავშვ-პუღის მასშტაბის მიხედვით (ღვიძლის რბილი ფუნქციის დაქვეითება), Cmax და AUC∞ გაიზარდა 7% და 10%, შესაბამისად, შემცირდა 4% -ით და გაიზარდა 11% -ით, შესაბამისად, პაციენტებში, რომლებსაც აქვთ ღვიძლის ფუნქციის დარღვევა ღვიძლის ფუნქციის დარღვევით, ბავშვ-პუღის მასშტაბის მიხედვით (ღვიძლის ფუნქციის დარღვევა ზომიერი სიმძიმით). ეს განსხვავებები არ განიხილება როგორც კლინიკურად მნიშვნელოვანი. დოზის კორექცია პაციენტებში ღვიძლის მსუბუქი ან ზომიერი უკმარისობით არ არის საჭირო. პრეპარატის გამოყენებასთან დაკავშირებული კლინიკური გამოცდილება არ არსებობს პაციენტებში, ღვიძლის უკმარისობის მძიმე დარღვევით (ბავშვთა და პუპის მასშტაბით კლასი C), ამიტომ პაციენტთა ამ ჯგუფში კანაგლიფლოზინის გამოყენება უკუნაჩვენებია.
ხანდაზმული პაციენტები (≥65 წლის ასაკში)
მოსახლეობის ფარმაკოკინეტიკური ანალიზის შედეგების მიხედვით, ასაკს არ ჰქონდა კლინიკურად მნიშვნელოვანი გავლენა კანაგლიფლოცინის ფარმაკოკინეტიკაზე.
ბავშვები (
ბავშვებში კანაგლიფლოცინის ფარმაკოკინეტიკის შესწავლა არ ჩატარებულა.
პაციენტების სხვა ჯგუფები
დოზის კორექტირება სქესის, რასის / ეთნოსის ან სხეულის მასის ინდექსის საფუძველზე არ არის საჭირო. ფარმაკოკინეტიკური მოსახლეობის ანალიზის შედეგების მიხედვით, ამ მახასიათებლებს არ გააჩნიათ კლინიკურად მნიშვნელოვანი გავლენა კანაგლიფლოცინის ფარმაკოკინეტიკაზე.
უკუჩვენებები
- ჰიპერმგრძნობელობა კანაგლიფლოზინზე ან პრეპარატის ნებისმიერი აღმძვრელის მიმართ,
- ტიპი 1 დიაბეტი
- დიაბეტური კეტოაციდოზი,
- თირკმლის უკმარისობა გლომერულური ფილტრაციის სიჩქარით (GFR) 2,
- ღვიძლის უკმარისობა
- ლაქტოზის შეუწყნარებლობა, ლაქტაზას დეფიციტი, გლუკოზა-გალაქტოზას მალაბსორბცია,
- გულის ქრონიკული უკმარისობა III - IV ფუნქციური კლასი (NYHA კლასიფიკაცია),
- ორსულობა და ძუძუთი კვების პერიოდში, 18 წლამდე ასაკის ბავშვები.
დიაბეტური კეტოაციდოზის ისტორიით
გამოიყენეთ ორსულობის დროს და ძუძუთი კვების პერიოდში
ძუძუთი კვების პერიოდში
კანაგლიფლოზინის გამოყენება უკუნაჩვენებია ქალებში ძუძუთი კვების პერიოდში. ცხოველების კვლევების ფარმაკოდინამიკური / ტოქსიკოლოგიური მონაცემების თანახმად, კანაგლიფლოზი გადადის დედის რძეში. არ არის ცნობილი, გადადის კანაგლიფლოზინი ადამიანის რძეში.
დოზირება და მიღება
დოზის გამოტოვება
თუ დოზა გამოტოვებულია, ეს უნდა მიიღოთ რაც შეიძლება მალე, თუმცა, ორმაგი დოზა არ უნდა მიიღოთ ერთ დღეში.
სპეციალური კატეგორიის პაციენტები
18 წლამდე ბავშვები
ბავშვებში კანაგლიფლოზინის უსაფრთხოება და ეფექტურობა არ არის შესწავლილი.
ხანდაზმული პაციენტები
75 წელზე უფროსი ასაკის პაციენტებს უნდა მიიღონ 100 მგ დღეში ერთხელ, საწყისი დოზის მიღებისას. გასათვალისწინებელია თირკმლის ფუნქციონირება და ჰიპოვოლემიის განვითარების რისკი.
თირკმლის ფუნქციის დაქვეითება
თირკმელების მსუბუქი უკმარისობის მქონე პაციენტებში (გლომერულარული ფილტრაციის სიჩქარე (GFR) 60-დან 90 მლ / წთ / 1.73 მ 2-მდე), დოზის კორექცია არ არის საჭირო.
პაციენტებში, რომლებსაც აქვთ თირკმლის ფუნქციის დარღვევა GFR- ით 45-დან 60 მლ / წთ / 1.73 მ 2-ზე, რეკომენდებულია პრეპარატის გამოყენება 100 მგ დოზით დღეში ერთხელ.
კანაგლიფლოზინი არ არის რეკომენდებული თირკმლის ფუნქციის დარღვევის მქონე პაციენტებისთვის, GFR 2, თირკმლის ქრონიკული უკმარისობის (სტადიის) სტადიის ეტაპზე, ან დიალიზიით დაავადებულ პაციენტებში, რადგან მოსალოდნელია, რომ კანაგლიფლოზინი არაეფექტური იქნება ამ პაციენტების პოპულაციაში.
გვერდითი ეფექტი
გვერდითი რეაქციები, რომლებიც დაკავშირებულია ინტრავასკულური მოცულობის შემცირებასთან
ყველა გვერდითი რეაქციის სიხშირე, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან (პოსტულარული თავბრუსხვევა, ორთოსტატული ჰიპოტენზია, არტერიული ჰიპოტენზია, გაუწყლოება და გამონაყარის დაგროვება) იყო 1.2% კანაგლიფლოზინის გამოყენებისას 100 მგ დოზით, 1.3% კანაგლიფლოზინის გამოყენებისას 300 მგ დოზით და პლაცებოზე 1.1%. არასასურველი რეაქციების სიხშირე, რომელიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან ერთად, ნარკოტიკების Invokana using გამოყენებისას, შედარებითი იყო იმ პრეპარატების გამოყენებისას, რომლებიც აქტიურად კონტროლირებად ორ კვლევას იყენებენ.
გულ-სისხლძარღვთა რისკების შესწავლისას, რომელშიც შედის პაციენტები, საშუალოდ ხანდაზმულ პაციენტებში და თანმდევი დაავადებების უფრო მაღალი პრევალენტობით, ინტრავასკულარული მოცულობის შემცირებასთან დაკავშირებული გვერდითი რეაქციების შემთხვევა იყო 2.8%, კანაგლიფლოზინის გამოყენებისას 100 მგ დოზით, 4 , კანაგლიფლოზინის გამოყენებისას 6% 300 მგ დოზით და პლაცებო გამოყენებისას 1.9%.
განზოგადებული ანალიზის შედეგების თანახმად, პაციენტებს, რომლებმაც მიიღეს "მარყუჟის" შარდმდენი საშუალებები, თირკმლის ზომიერი უკმარისობის მქონე პაციენტები (GFR 30-დან 60 მლ / წთ / 1.73 მ 2) და 75 წელზე უფროსი ასაკის პაციენტებს აღენიშნებათ ამ არასასურველი პაციენტების უფრო მაღალი შემთხვევები. რეაქციები. იმ პაციენტებში, რომლებმაც მიიღეს "მარყუჟის" შარდმდენი საშუალებები, კანაგლიფლოზინის გამოყენებისას სიხშირე იყო 3.2% 100 მგ დოზით, 8.8% დოზით 300 მგ და საკონტროლო ჯგუფში 4.7%. საწყის GFR 2 პაციენტებში სიხშირე იყო 4.8% კანაგლიფლოზინის გამოყენებისას 100 მგ დოზით, 8.1% 300 მგ დოზით, ხოლო საკონტროლო ჯგუფში 2.6%. 75 წელზე უფროსი ასაკის პაციენტებში, კანაგლიფლოზინის გამოყენებისას სიხშირე იყო 4.9% 100 მგ დოზით, 8.7% დოზით 300 მგ და საკონტროლო ჯგუფში 2.6%.
გულ-სისხლძარღვთა რისკების შესახებ კვლევის ჩატარებისას, პრეპარატის მიღების შეწყვეტის სიხშირე არასასურველი რეაქციების წარმოქმნის გამო, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან, და ასეთი სერიოზული გვერდითი რეაქციების სიხშირე კანაგლიფლოზინის გამოყენებასთან არ გაზრდის.
ჰიპოგლიკემია, როდესაც გამოიყენება ინსულინთერაპიის დამხმარე საშუალებად ან აგენტებად, რომლებიც აძლიერებენ მის სეკრეციას
ჰიპოგლიკემიის სიხშირე დაბალია (100 მგ, 300 მგ და პლაცებო ®, შესაბამისად; მძიმე ჰიპოგლიკემია დაფიქსირდა 1.8%, 2.7% და 2.5% პაციენტებში, რომლებმაც მიიღეს Invocana ® დოზით 100 მგ, 300 მგ და პლაცებო, შესაბამისად, კანაგლიფლოზინის, როგორც სულფონილურას წარმოებულების შემცვლელის გამოყენებისას, ჰიპოგლიკემია დაფიქსირდა პაციენტთა 4.1%, 12.5% და 5.8% -ში, რომლებმაც მიიღეს Invocana ® დოზით 100 მგ, 300 მგ და პლაცებო, შესაბამისად.
სასქესო ორგანოების სოკოვანი ინფექციები
კანდიდოზი ვულვოვაგინიტიტი (ვულვოვაგინიტიისა და ვულვოვაგინალური სოკოვანი ინფექციის ჩათვლით) დაფიქსირდა იმ ქალთა 10.4%, 11.4% და 3.2% -ში, რომლებმაც მიიღეს პრეპარატი Invokana ® დოზით 100 მგ, 300 მგ და პლაცებო. ვულვოვაგინალური კანდიდოზის შესახებ ყველაზე მეტი ინფორმაცია კანაგლიფლოზინით მკურნალობის დაწყებიდან პირველ ოთხ თვეში. კანაგლიფლოზინით დაავადებულ პაციენტებს შორის 2.3% -ს აღენიშნება ინფექციის ერთზე მეტი ეპიზოდი. კანდიდური ვულვოვაგინიტის გამო, ყველა პაციენტის 0.7% –მა შეაჩერა კანაფლიფლოზინის მიღება.
კანდიდოზი ბალანიტი ან ბალანოპოსტიტი დაფიქსირდა მამაკაცების 4.2%, 3.7% და 0.6% -ში, რომლებმაც მიიღეს პრეპარატი Invokana ® დოზით 100 მგ, 300 მგ და პლაცებო. კანაგლიფლოზინით დაავადებულ პაციენტებს შორის 0,9% -ს აღენიშნებოდა ინფექციის ერთზე მეტი ეპიზოდი. ყველა პაციენტის 0.5% –მა შეაჩერა კანაფლიფლოზინის მიღება კანდიდოზიანი ან ბალანოპოსტიტის გამო. ფიმოზი აღინიშნა მამაკაცთა 0.3% -ში, რომლებმაც არ გაიარეს წინადაცვეთა. შემთხვევების 0.2% -ში, წინადაცვეთილი იქნა პაციენტები, რომლებმაც მიიღეს კანაფლიფლოზინი.
საშარდე გზების ინფექციები
საშარდე გზების ინფექციები დაფიქსირდა პაციენტების 5.9%, 4.3% და 4.0% -ში, რომლებმაც მიიღეს პრეპარატი Invokana ® დოზით 100 მგ, 300 მგ და პლაცებო. ინფექციების უმეტესობა სიმძიმის ზომიერი ან ზომიერი იყო; სერიოზული გვერდითი რეაქციების სიხშირე არ გაიზარდა. პაციენტებმა უპასუხეს სტანდარტულ მკურნალობას და განაგრძეს კანაგლიფლოზინით თერაპია. განმეორებითი ინფექციების სიხშირე არ გაიზარდა კანაგლიფლოზინის გამოყენებასთან.
ძვლის მოტეხილობები
გულ-სისხლძარღვთა შედეგების შესწავლისას 4327 პაციენტში, რომელთაც აქვთ დიაგნოზირებული გულსისხლძარღვთა დაავადება ან მაღალი გულ-სისხლძარღვთა რისკი, ძვლების მოტეხილობების შემთხვევა იყო 16.3, 16.4 და 1000 პაციენტზე 10,8 პაციენტი-წელიწადში 100 მგ დოზით Invocana. და 300 მგ და პლაცებო, შესაბამისად. თერაპიის პირველ 26 კვირაში მოხდა მოტეხილობების შემთხვევების დისბალანსი.
Invokana the - ს სხვა კვლევების ერთობლივი ანალიზის დროს, რომელშიც შედის 5800 პაციენტი, რომლებსაც აქვთ ტიპის 2 დიაბეტი დიაბეტი ზოგადი პოპულაციიდან, კონტროლთან მიმართებაში არ არსებობს განსხვავებები მოტეხილობების რისკის მხრივ.
104 კვირის მკურნალობის შემდეგ, კანაგლიფლოზინმა უარყოფითად არ იმოქმედა ძვლის მინერალის სიმკვრივეზე.
ლაბორატორიული ცვლილებები
შრატში კალიუმის კონცენტრაციის გაზრდა
შრატში კალიუმის კონცენტრაციის საშუალო ცვლილება საწყისი საწყისი მნიშვნელობიდან შეადგენდა 0.5%, 1.0% და 0.6% პრეპარატის Invokana when გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შრატში კალიუმის კონცენტრაციის გაზრდის შემთხვევები (> 5.4 მკგ / ლ და 15% უფრო მაღალი ვიდრე საწყისი კონცენტრაცია) დაფიქსირდა კანაგლიფლოზინის 100 მგ დოზით მიღება კანაგლიფლოზინის 100 მგ დოზით პაციენტთა 7.0% -ში, პაციენტთა 7.0% -ში, რომლებიც კანაგლიფლოზინს იღებენ 300 მგ დოზით. და 4.8% პაციენტებში, რომლებიც იღებენ პლაცებოს. ზოგადად, კალიუმის კონცენტრაციის მატება იყო უმნიშვნელო (® დოზებით 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შარდმჟავას კონცენტრაციის საშუალო ცვლილება საწყისი საწყისი მნიშვნელობიდან 17.1%, 18.0% და 2.7% შეადგენდა წამალს Invokana when გამოყენებისას) დოზები 100 მგ, 300 მგ და პლაცებო, შესაბამისად, ეს ცვლილებები ჩვეულებრივ აღინიშნა თერაპიის დაწყებიდან 6 კვირის განმავლობაში, შემდგომში კრეატინინის კონცენტრაცია თანდათანობით შემცირდა მის თავდაპირველ ღირებულებამდე, შარდოვანის აზოტის კონცენტრაცია სტაბილურად დარჩა.
GFR- ს (უფრო მნიშვნელოვანი შემცირება) პაციენტთა წილით (> 30%) შედარებით მკურნალობის ნებისმიერ ეტაპზე დაფიქსირებულ საწყის დონეზე იყო 2.0% კანაგლიფლოზინის გამოყენებისას 100 მგ დოზით, 4.1% პრეპარატის გამოყენებისას 300 მგ და 2 დოზით. , 1% პლაცებოზე. GFR– ის ეს შემცირება ხშირად გარდამავალი იყო, ხოლო კვლევის ბოლოს, GFR– ის ანალოგიური დაქვეითება დაფიქსირდა უფრო ნაკლებ პაციენტებში: 0.7% კანაგლიფლოზინით 100 მგ დოზით, 1.4% –ით 300 მგ და 0.5% –ით. პლაცებო პროგრამა.
კანაგლიფლოზინის შეჩერების შემდეგ, ლაბორატორიულ პარამეტრებში ამ ცვლილებებმა განიცადა დადებითი დინამიკა ან დაუბრუნდა პირვანდელ დონეზე.
ქოლესტერინის კონცენტრაციის ცვლილება
საწყისი კონცენტრაციიდან LDL– ს საშუალო ცვლილებები პლაცებოსთან შედარებით იყო 0.11 მმოლ / ლ (4.5%) და 0.21 მმოლ / ლ (8.0%) კანაგლიფლოზინის გამოყენებისას დოზებში 100 მგ და 300 მგ შესაბამისად. საწყისი ქულით ქოლესტერინის კონცენტრაციის მცირე ზრდა დაფიქსირდა პლაცებოსთან შედარებით - 2.5% და 4.3% კანაგლიფლოზინის გამოყენებისას დოზებში 100 მგ და 300 მგ შესაბამისად. საწყისი კონცენტრაციიდან HDL– ის ზრდა პლაცებოსთან შედარებით იყო 5.4% და 6.3% კანაგლიფლოზინის გამოყენებისას დოზებში 100 მგ და 300 მგ, შესაბამისად. ქოლესტერინის კონცენტრაციის მატება, რომელიც არ ასოცირდება HDL– ს საწყისი პლაცებოსთან შედარებით, იყო 0.05 მმოლ / ლ (1.5%) და 0.13 მმოლ / ლ (3.6%) კანაგლიფლოზინის გამოყენებისას 100 მგ დოზებში და 300 მგ, შესაბამისად. LDL / HDL– ის თანაფარდობა არ შეცვლილა ნარკოტიკების Invokana the გამოყენებასთან პლაცებოსთან შედარებით. აპოლიპოპროტეინების B- ის კონცენტრაცია, LDL ნაწილაკების რაოდენობა და ქოლესტერინის კონცენტრაცია, რომლებიც არ არის დაკავშირებული HDL– სთან, არანაკლებ გაიზარდა LDL კონცენტრაციის ცვლილებებთან შედარებით.
გაზრდილი ჰემოგლობინის კონცენტრაცია
პირველადი მნიშვნელობიდან ჰემოგლობინის კონცენტრაციის საშუალო ცვლილებები იყო 4.7 გ / ლ (3.5%), 5.1 გ / ლ (3.8%) და 1.8 გ / ლ (-1.1%), როდესაც გამოყენებულია კანაგლიფლოცინი დოზებით 100 მგ, 300 მგ და პლაცებო, შესაბამისად. დაფიქსირდა სისხლის წითელი უჯრედების რაოდენობის და ჰემატოკრიტის რაოდენობის საშუალო პროცენტული ცვლილების შედარებითი მცირე ზრდა საწყისი საწყისიდან. მკურნალობის დასასრულს, პაციენტთა 4.0%, 2.7% და 0.8%, რომლებიც მკურნალობდნენ Invocana დოზებით 100 მგ, 300 მგ და პლაცებოზე, შესაბამისად, ჰქონდა ჰემოგლობინის კონცენტრაცია უფრო მაღალი ვიდრე ნორმალური ზედა ზღვარი.
შრატში ფოსფატის კონცენტრაციის გაზრდა
პრეპარატის Invokana using გამოყენებისას დაფიქსირდა დოზადამოკიდებული ზრდა შრატში ფოსფატის კონცენტრაციაში. 4 კლინიკურ კვლევაში, შრატის ფოსფატის კონცენტრაციის საშუალო ცვლილებებმა შეადგენდა 3.6%, 5.1% და 1.5% კანაგლიფლოზინის გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შრატში ფოსფატის კონცენტრაციის გაზრდის საწყისი საწყისი საწყისი 25% -ზე მეტი შემთხვევა დაფიქსირდა იმ პაციენტთა 0.6%, 1.6% და 1.3% -ში, რომლებმაც მიიღეს მკურნალობა Invocana – ით, დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად.
შარდმჟავას კონცენტრაციის შემცირება
კანაგლიფლოცინის დოზით 100 მგ და 300 მგ დოზით გამოყენებისას დაფიქსირდა შარდმჟავას საშუალო კონცენტრაციის ზომიერი შემცირება საწყისი დონიდან (შესაბამისად −10.1% და −10.6%), პლაცებოსთან შედარებით, რომლის გამოყენებამ შეამცირა საშუალო კონცენტრაციის მცირედი ზრდა საწყისი საწყისიდან (1.9%). შრატში შარდმჟავას კონცენტრაციის დაქვეითება კანაგლიფლოცინის ჯგუფებში მაქსიმალური იყო ან მაქსიმალური სიახლოვე მე -6 კვირაში და გაგრძელდა მთელი თერაპიის განმავლობაში. აღინიშნა შარდმჟავას კონცენტრაციის დროებითი ზრდა შარდში. კანაგლიფლოზინის გამოყენების 100 მგ და 300 მგ დოზებში გამოყენებული კომბინირებული ანალიზის შედეგების თანახმად, ნაჩვენები არ არის, რომ ნეფროლიტიაზის შემთხვევები არ გაზრდილა.
გულ-სისხლძარღვთა უსაფრთხოება
გულ-სისხლძარღვთა რისკის ზრდა არ აღინიშნა კანაგლიფლოზინთან პლაცებო ჯგუფთან შედარებით.
გვერდითი რეაქციები სპეციალურ პაციენტთა ჯგუფებში
ხანდაზმული პაციენტები
ხანდაზმულ პაციენტებში უსაფრთხოების დაცვა ზოგადად შეესაბამება ახალგაზრდა პაციენტებს. 75 წელზე უფროსი ასაკის პაციენტებს აღენიშნებოდათ გვერდითი მოვლენების უფრო მაღალი შემთხვევა, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან (პოსტულარული თავბრუსხვევა, ორთოსტატული ჰიპოტენზია, არტერიული ჰიპოტენზია) - 4.9%, 8.7% და 2.6%, წამლის Invokana using დოზების გამოყენების დროს. 100 მგ, 300 მგ და პლაცებო, შესაბამისად. დაფიქსირდა GFR– ის შემცირება 3.6%, 5.2% და 3.0% –ით, წამლის Invokana using გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად.
GFR პაციენტები 45-დან 60 მლ / წთ / 1.73 მ 2-მდე
პაციენტებში, რომლებსაც აქვთ GFR საწყისი ღირებულება 45-60 მლ / წთ / 1.73 მ 2, არასასურველი მოვლენების სიხშირე, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან, იყო 4.6%, 7.1% და 3.4% პრეპარატი Invokana ® დოზების გამოყენების დროს. 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შრატში კრეატინინის კონცენტრაცია გაიზარდა 4.9%, 7.3% და 0.2% პრეპარატის Invokana when გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შარდმჟავას აზოტის კონცენტრაცია გაიზარდა 13.2%, 13.6% და 0.7% პრეპარატის Invokana when გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად. პაციენტებში, რომლებსაც აქვთ GFR– ის დიდი დაქვეითება (> 30%) მკურნალობის დროს ნებისმიერ დროს იყო 6.1%, 10.4% და 4.3% პრეპარატი Invocana when გამოყენებისას, დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად.კვლევის დასასრულს, ეს წილი იყო 2.3%, 4.3% და 3.5% პრეპარატი Invokana when გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად.
შრატში კალიუმის კონცენტრაციის გაზრდის სიხშირე (> 5.4 მკგ / ლ და საწყისი მნიშვნელობის 15%) პრეპარატი Invocana using გამოყენებისას 5.2%, 9.1% და 5.5% იყო, შესაბამისად, 100 მგ, 300 მგ და პლაცებო, . იშვიათად, შრატში კალიუმის კონცენტრაციის უფრო მაღალი მატება აღინიშნება თირკმელების ზომიერი უკმარისობის მქონე პაციენტებში, რომლებსაც ადრე ჰქონდათ შრატში კალიუმის კონცენტრაციის მატება და / ან მკურნალობდნენ რამდენიმე პრეპარატი კალიუმის ექსკრეციის შესამცირებლად, მაგალითად, კალიუმის შემცველი შარდმდენი საშუალებებით და ანგიოტენზინებით გარდამქმნელი ფერმენტის ინჰიბიტორებით. ზოგადად, კონცენტრაციის ეს ზრდა გარდამავალი იყო და არ საჭიროებს სპეციფიკურ მკურნალობას.
შრატში ფოსფატის კონცენტრაცია გაიზარდა 3.3%, 4.2% და 1.1% -ით პრეპარატი Invokana when გამოყენებისას დოზებში 100 მგ, 300 მგ და პლაცებო, შესაბამისად. შრატში ფოსფატის კონცენტრაციის ზრდის სიხშირე (> 1.65 მმოლ / ლ და საწყისი მაჩვენებლის 25% უფრო მაღალია) პრეპარატი Invokana using გამოყენებისას 1,4%, 1.3% და 0.4% იყო 100 მგ, 300 მგ და პლაცებო შესაბამისად. ზოგადად, კონცენტრაციის ეს ზრდა გარდამავალი იყო და არ საჭიროებს სპეციფიკურ მკურნალობას.
რეგისტრაციის შემდგომი მონაცემები
ცხრილში 1 მოცემულია არასასურველი მოვლენები, რომლებიც დაფიქსირებულია პოსტ-რეგისტრაციის დაკვირვების დროს. გვერდითი მოვლენები სისტემატიზებულია ორგანოების თითოეული სისტემის მიმართ, კლების სიხშირეზე, შემდეგი კლასიფიკაციის გამოყენებით: ძალიან ხშირად (> 1/10), ხშირად (> 1/100,> 1/1000,> 1/10000,
გადაჭარბებულმა
მკურნალობა
დოზის გადაჭარბების შემთხვევაში აუცილებელია ჩვეული დამხმარე ზომების ჩატარება, მაგალითად, კუჭ-ნაწლავის ტრაქტიდან არ შეიწოვება ნივთიერების ამოღება, კლინიკური დაკვირვების ჩატარება და ჩატარდეს შემანარჩუნებელი მკურნალობა პაციენტის კლინიკური მდგომარეობის გათვალისწინებით. კანაგლიფლოზინი პრაქტიკულად არ გამოიყოფა 4-საათიანი დიალიზის დროს. კანაგლიფლოზინის გამოყოფა არ არის საჭირო პერიტონეალური დიალიზის საშუალებით.
ურთიერთქმედება სხვა პრეპარატებთან
ინ ვიტრო ურთიერთქმედების შეფასება
კანაგლიფლოცინის მეტაბოლიზმი ძირითადად გვხვდება გლუკურონიდაზაციით UDF- გლუკურონიოსილტრანსფერაზების საშუალებით UGT1A9 და UGT2B4.
კვლევებში in vitro კანაგლიფლოზინმა არ შეუშალა ციტოქრომ P450- ის (1A2, 2A6, 2C19, 2D6, 2E1, 2B6, 2C8, 2C9) იზოენზიმები და არ გამოიყვანა იზოენზიმები 1A2, 2C19, 2B6, 3A4 .. კანაგლიფლოზინი სუსტად აინჰიბირებს CYP3 in vitroამასთან, კლინიკურ კვლევებში კლინიკურად მნიშვნელოვანი ურთიერთქმედებები არ გამოვლენილა. კანაგლიფლოზინი არ არის მოსალოდნელი, რომ შეცვალოს თანაბრად გამოყენებული წამლების მეტაბოლური კლირენსი ამ იზოენზიებით მეტაბოლიზებულმა.
კანაგლიფლოზინი წარმოადგენს P- გლიკოპროტეინების სუბსტრატს (P-gp) და სუსტად ახდენს P-gp- შუამავლობით დიგოქსინის ტრანსპორტს.
In vivo ურთიერთქმედების შეფასება
სხვა პრეპარატების მოქმედება კანაგლიფლოზინზე
ციკლოსპორინი, ჰიდროქლოროთიაზიდი, ზეპირი კონტრაცეპტივები (ლევონორგესტრელი + ეთინილ ესტრადიოლი), მეტფორმინი და პრობენეციდი არ ახდენდნენ კლინიკურად მნიშვნელოვან გავლენას კანაგლიფლოზინის ფარმაკოკინეტიკაზე.
რიფამპიცინი. რიფამპიცინის ერთდროულმა გამოყენებამ, UGT ოჯახის და წამლის გადამტანების რიგი ფერმენტების არაელექციური გამომწვევი, მათ შორის UGT1A9, UGT2B4, P-gp და MRP2, შეამცირა კანაგლიფლოზინის ექსპოზიცია, რამაც შეიძლება გამოიწვიოს მისი ეფექტურობის დაქვეითება. თუ საჭიროა ინიშნება UGT ოჯახის ფერმენტების შემცველი ინდიკატორის და წამლების მატარებლების (მაგალითად, რიფამპიცინი, ფენიტოინი, ბარბიტურატები, ფენობარბიტალი, რიტონავირი, კარბამაზეპინი, ეფავირენცი, წმინდა იოანეს ვორტის პერფორირებული) ერთდროულად კანაგლიფლოცინის კონცენტრაციის მონიტორინგი, აუცილებელია გლიცენტირებული დოზით 100 მგ კონცენტრაციის კონტროლი. დღეში ერთხელ და უზრუნველყოს კანაგლიფლოზინის დოზის 300 მგ დღეში გაზრდა, თუ აუცილებელია გლიკემიის დამატებითი კონტროლი. GFR- ის პაციენტებისთვის 45-დან 60 მლ / წთ / 1.73 მ 2 მიღებაზე, პრეპარატი Evokana receiving დოზით 100 მგ და ფერმენტების UGT- ის ინდუქციური წამლის მიღება, და ვისაც სჭირდება დამატებითი გლიკემიური კონტროლი, საჭიროა გათვალისწინებულ იქნას სხვა ჰიპოგლიკემიური აგენტების დანიშვნა.
ცხრილი 2: ნარკოტიკების ერთდროული გამოყენების ეფექტი კანაგლიფლოზინის ექსპოზიციაზე
| თანმდევი წამლები | თანმდევი დოზა 1 | კანაგლიფლოზინის დოზა 1 | გეომეტრიული საშუალო რაციონი (დანიშვნის მაჩვენებლების თანაფარდობა ერთდროული მკურნალობა / მის გარეშე) არანაირი ეფექტი = 1.0 | |
| AUC 2 (90% CI) | მაქსიმ (90% CI) | |||
| შემდეგ შემთხვევებში, კანაგლიფლოცინის დოზის კორექცია არ არის საჭირო: | ||||
| ციკლოსპორინი | 400 მგ | 300 მგ 1 ჯერ დღეში 8 დღის განმავლობაში | 1,23 (1,19–1.27) | 1,01 (0,91–1,11) |
| ლევონორგესტრელი + ეთინილ ესტრადიოლი | ლევონორგესტრელი 0.15 მგ ეთინილ ესტრადიოლი 0.03 მგ | 200 მგ 1 ჯერ დღეში 6 დღის განმავლობაში | 0,91 (0,88–0,94) | 0,92 (0,84–0,99) |
| ჰიდროქლოროთიაზიდი | 25 მგ 1 ჯერ დღეში 35 დღის განმავლობაში | 300 მგ 1 ჯერ დღეში 7 დღის განმავლობაში | 1,12 (1,08–1,17) | 1,15 (1,06–1,25) |
| მეტფორმინი | 2000 მგ | 300 მგ 1 ჯერ დღეში 8 დღის განმავლობაში | 1,10 (1,05–1,15) | 1,05 (0,96–1,16) |
| პრობენეციდი | 500 მგ 2 ჯერ დღეში 3 დღის განმავლობაში | 300 მგ 1 ჯერ დღეში 17 დღის განმავლობაში | 1,21 (1,16–1,25) | 1,13 (1,00–1,28) |
| რიფამპიცინი | 600 მგ 1 ჯერ დღეში 8 დღის განმავლობაში | 300 მგ | 0,49 (0,44–0,54) | 0,72 (0,61–0,84) |
2. AUCinf ერთჯერადი დოზა და AUC24 - მრავალჯერადი დოზით დადგენილი სამკურნალო საშუალებებისათვის.
კანაგლიფლოზინის მოქმედება სხვა პრეპარატებზე
ჯანმრთელ მოხალისეებში კლინიკურ კვლევებში კანაგლიფლოზინს არ გააჩნია მნიშვნელოვანი წონასწორობა მეტფორმინის, ზეპირი კონტრაცეპტივების (ლევონორგესტრელი + ეთინილ ესტრადიოლი), გლიბენკლამიდის, სიმვასტატინის, პარაცეტამოლის, ჰიდროქლოროთიაზიდის და ვარფარინის ფარმაკოკინეტიკაზე.
დიგოქსინი. კანაგლიფლოზინის ერთობლიობის (300 მგ დღეში 7 დღის განმავლობაში) და დიგოქსინის (0.5 მგ დღეში 1 და 0.25 მგ მომდევნო 6 დღის განმავლობაში) გამოყენებამ გამოიწვია AUC და Cmax დიგოქსინის 20% და 36-ით გაზრდა. შესაბამისად, შესაძლოა, P-gp- ზე შუამავლობით ურთიერთქმედების გამო. პაციენტები, რომლებიც იღებენ დიგოქსინს ან გულის გლიკოზიდების სხვა (მაგ., დიგოქსინი), უნდა ჩატარდეს სათანადო მონიტორინგი.
ცხრილი 3: კანაგლიფლოზინის ეფექტი თანაბარი წამლების ექსპოზიციის შესახებ
| თანმდევი წამლები | თანმდევი დოზა 1 | კანაგლიფლოზინის დოზა 1 | გეომეტრიული საშუალო რაციონი (დანიშვნის მაჩვენებლების თანაფარდობა ერთდროული მკურნალობა / მის გარეშე) არანაირი ეფექტი = 1.0 | ||
| AUC 2 (90% CI) | მაქსიმ (90% CI) | ||||
| შემდეგ შემთხვევებში, თანმხლები პრეპარატების დოზის კორექცია არ არის საჭირო: | |||||
| დიგოქსინი | 0.5 მგ 1 ჯერ 1 დღეს, შემდეგ 0.25 მგ 1 ჯერ დღეში 6 დღის განმავლობაში | 300 მგ დღეში ერთხელ 7 დღის განმავლობაში | დიგოქსინი | 1,20 (1,12–1,28) | 1,36 (1,21–1,53) |
| ლევონორგესტრელი + ეთინილ ესტრადიოლი | ლევონორგესტრელი 0.15 მგ ეთინილ ესტრადიოლი 0.03 მგ | 200 მგ დღეში ერთხელ 6 დღის განმავლობაში | ლევონორგესტრელი | 1,06 (1,00–1,13) | 1,22 (1,11–1,35) |
| ეთინილ ესტრადიოლი | 1,07 (0,99–1,15) | 1,22 (1,10–1,35) | |||
| გლიბენკლამიდი | 1.25 მგ | 200 მგ დღეში ერთხელ 6 დღის განმავლობაში | გლიბენკლამიდი | 1,02 (0,98–1,07) | 0,93 (0,85–1,01) |
| ჰიდროქლოროთიაზიდი | 25 მგ დღეში ერთხელ 35 დღეში | 300 მგ დღეში ერთხელ 7 დღის განმავლობაში | ჰიდროქლოროთიაზიდი | 0,99 (0,95–1,04) | 0,94 (0,87–1,01) |
| მეტფორმინი | 2000 მგ | 300 მგ დღეში ერთხელ 8 დღის განმავლობაში | მეტფორმინი | 1,20 (1,08–1,34) | 1,06 (0,93–1,20) |
| პარაცეტამოლი | 1000 მგ | 300 მგ 2-ჯერ დღეში 25 დღის განმავლობაში | პარაცეტამოლი | 1,06 3 (0,98–1,14) | 1,00 (0,92–1,09) |
| სიმვასტატინი | 40 მგ | 300 მგ დღეში ერთხელ 7 დღის განმავლობაში | სიმვასტატინი | 1,12 (0,94–1,33) | 1,09 (0,91–1,31) |
| ვარფარინი | 30 მგ | 300 მგ დღეში ერთხელ 12 დღის განმავლობაში | (რ) - ვარფარინი | 1,01 (0,96–1,06) | 1,03 (0,94–1,13) |
| (ს) -ვარფარინი | 1,06 (1,00–1,12) | 1,01 (0,90–1,13) | |||
| INR | 1,00 (0,98–1,03) | 1,05 (0,99–1,12) | |||
2. AUCინფ ერთჯერადი დოზა და AUC24 სთ - მრავალჯერადი დოზით დადგენილი მედიკამენტებისთვის
3. AUC0-12 სთ
ეფექტი ლაბორატორიული ტესტის შედეგებზე
ანალიზი 1,5-AG– ზე
კანაგლიფლოზინის გავლენის ქვეშ თირკმელების მიერ გლუკოზის მომატება შეიძლება გამოიწვიოს 1,5-ანჰიდროგლუციტოლის (1,5-AG) კონცენტრაციის ცრუ შემცირებამ და მისი შესრულება საეჭვო გახდეს. ამიტომ, 1,5-AG კონცენტრაცია არ უნდა იქნას გამოყენებული გლიკემიური კონტროლის შესაფასებლად პაციენტებში, რომლებიც იღებენ Invocana. დამატებითი ინფორმაციისთვის, რეკომენდირებულია დაუკავშირდით 1.5-AG ტესტის მწარმოებელს.
შარდის გლუკოზის ანალიზი
კანაგლიფლოზინის მოქმედების მექანიზმის გათვალისწინებით, პაციენტებში, რომლებიც იღებენ პრეპარატ Invokana, შარდში გლუკოზის ტესტის შედეგი იქნება დადებითი.
გვაფრთხილებს
დიაბეტური კეტოაციდოზი (DKA)
პაციენტები, რომლებსაც აქვთ დიაბეტური კეტოაციდოზის ანამნეზი, გამოირიცხეს კლინიკური კვლევები. სიფრთხილეა რეკომენდებული პრეპარატის Invokana use გამოყენება DKA- ს ანამნეზით დაავადებულ პაციენტებში. ბევრ პაციენტში დაფიქსირდა ისეთი პირობები, რომ გაიზარდა DKA– ს რისკი (მაგალითად, ინფექცია, ინსულინთერაპიის შეწყვეტა).
ტიპი 1 დიაბეტი
პაციენტები, რომლებსაც აქვთ 1 ტიპის დიაბეტი, იღებენ წამალს Invokana, DKA– ს გაზრდილი რისკი. 18-კვირიან კლინიკურ კვლევაში, DKA მოხდა 5.1% (6/117), 9.4% (11/117) და 0.0% (0/117) პაციენტებში, როდესაც იყენებდნენ წამალს Invokana ® დოზით 100 მგ, 300 მგ მგ და პლაცებო, შესაბამისად. DKA– ს გაჩენასთან დაკავშირებით, საჭიროა 12 პაციენტის ჰოსპიტალიზაცია, მათგან 5 – ში სისხლში გლუკოზის კონცენტრაცია 13.9 მმოლ / ლ-ზე დაბალი იყო.
ტიპი 2 დიაბეტი
ნარკოტიკების Invokana using გამოყენებისას პაციენტებში, რომლებსაც აქვთ ტიპი 2 შაქრიანი დიაბეტი, აღინიშნება DKA შემთხვევები. კლინიკური კვლევების თანახმად, სერიოზული გვერდითი რეაქციების განვითარება, როგორიცაა დიაბეტური კეტოაციდოზი, კეტოაციდოზი, მეტაბოლური აციდოზი, აღინიშნება პაციენტთა 0.09% -ში (10/10687) პაციენტებში, რომლებიც მკურნალობდნენ Invocana – ით, ყველა პაციენტი ჰოსპიტალიზირდა. დიაბეტური კეტოაციდოზის შემთხვევები, რომლებიც მოხდა გლუკოზის სისხლში კონცენტრაციით 13.9 მმოლ / ლ ქვემოთ, ასევე აღირიცხა რეგისტრაციის შემდგომი დაკვირვების დროს.
ამრიგად, მეტაბოლური აციდოზის მქონე მე -2 ტიპის შაქრიანი დიაბეტის მქონე პაციენტებში უნდა ჩაითვალოს DKA დიაგნოზი, მაშინაც კი, თუ სისხლში გლუკოზის კონცენტრაცია 13.9 მმოლ / ლ-ზე დაბალია. გვიან დიაგნოზის თავიდან ასაცილებლად და პაციენტის სათანადო მართვის უზრუნველსაყოფად, პაციენტებმა, რომლებიც იღებენ წამალს Invokana ®, უნდა გაიარონ ტესტირება კეტონებისთვის მეტაბოლური აციდოზის სიმპტომების შემთხვევაში, როგორიცაა სუნთქვის ქოშინი, გულისრევა, ღებინება, მუცლის ტკივილი, დაბნეულობა, ნაყოფი. ცუდი სუნთქვა, უჩვეულო დაღლილობა და ძილი.
DKA- ით შაქრიანი დიაბეტის ტიპის 2 პაციენტებში დაუყოვნებლივ უნდა შეწყვიტოთ წამლის Invokana ® გამოყენება. გასათვალისწინებელია ინვოქანასთან therapy თერაპიის შეწყვეტა პაციენტებში, რომლებსაც აქვთ ტიპი 2 დიაბეტი, ჰოსპიტალიზირებულია ფართო ქირურგიის ან მწვავე სერიოზული დაავადების შემთხვევაში. ინვოჩანას ® თერაპია შეიძლება განახლდეს, თუ პაციენტის მდგომარეობა სტაბილიზირებულია.
კანცეროგენულობა და მუტაგენურობა
წინასწარი კლინიკური მონაცემები არ წარმოადგენს სპეციფიკურ საფრთხეს ადამიანისთვის, უსაფრთხოების ფარმაკოლოგიური კვლევების შედეგების მიხედვით, განმეორებითი დოზების ტოქსიკურობა, გენოტოქსიკურობა, რეპროდუქციული და ონტოგენეტიკური ტოქსიკურობა.
ნაყოფიერება
კანაგლიფლოზინის მოქმედება ადამიანის ნაყოფიერებაზე არ არის შესწავლილი. ცხოველებზე ჩატარებულ კვლევებში არანაირი ნაყოფიერება არ დაფიქსირებულა.
ჰიპოგლიკემია ერთდროული გამოყენებით სხვა ჰიპოგლიკემიური საშუალებებით
ნაჩვენებია, რომ კანაგლიფლოზინის, როგორც მონოთერაპიის, ან, როგორც ჰიპოგლიკემიური აგენტების დანამატის გამოყენება (რომლის გამოყენებას თან არ ახლავს ჰიპოგლიკემიის განვითარება), იშვიათად მიგვიყვანა ჰიპოგლიკემიის განვითარებამდე. ცნობილია, რომ ინსულინი და ჰიპოგლიკემიური აგენტები, რომლებიც აძლიერებენ მის სეკრეციას (მაგალითად, სულფონილურას წარმოებულები), იწვევს ჰიპოგლიკემიის განვითარებას. კანაგლიფლოზინის, როგორც ინსულინთერაპიის დანამატის გამოყენებისას ან მისი სეკრეციის გაძლიერების გზით (მაგალითად, სულფონილურეას წარმოებულები) გამოყენებისას, ჰიპოგლიკემიის შემთხვევები უფრო მაღალი იყო, ვიდრე პლაცებოზე.
ამრიგად, ჰიპოგლიკემიის განვითარების რისკის შესამცირებლად, რეკომენდებულია ინსულინის ან აგენტების დოზის შემცირება, რაც აძლიერებს მის სეკრეციას.
ინტრავასკულური მოცულობის შემცირება
კანაგლიფლოზინს აქვს შარდმდენი მოქმედება თირკმელებით გლუკოზის ექსკრეციის გაზრდის გზით, იწვევს ოსმოზურ დიურეზს, რამაც შეიძლება გამოიწვიოს ინტრავასკულური მოცულობის შემცირება. პაციენტები, რომლებიც შეიძლება უფრო მგრძნობიარენი იყვნენ არასასურველი რეაქციებისგან, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან, მოიცავს პაციენტებს, რომლებიც იღებენ ”მარყუჟის” შარდმდენებს, პაციენტებს, რომლებსაც აქვთ თირკმლის ფუნქციის დარღვეული ზომიერი სიმძიმე და 75 წელზე უფროსი ასაკის პაციენტები.
კანაგლიფლოცინის კლინიკურ კვლევებში, გვერდითი რეაქციების სიხშირის ზრდა, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან (მაგ., პოსტულარული თავბრუსხვევა, ორთოსტატული ჰიპოტენზია ან არტერიული ჰიპოტენზია) უფრო ხშირად აღინიშნა პირველი სამი თვის განმავლობაში, როდესაც გამოყენებულ იქნა 300 მგ კანაგლიფლოცინი. კანაგლიფლოზინით მკურნალობის პირველი ექვსი კვირის განმავლობაში, აღინიშნა შრატში კრეატინინის მცირედი მატება და სავარაუდო GFR– ის ერთდროული დაქვეითება ინტრავასკულარული მოცულობის შემცირების გამო. პაციენტებში, რომლებიც მიდრეკილნი იყვნენ ინტრავასკულარული მოცულობის უფრო მეტ შემცირებას, როგორც ზემოთ აღინიშნა, ზოგჯერ აღინიშნა GFR- ის უფრო მნიშვნელოვანი დაქვეითება (> 30%), რაც შემდგომში გადაწყდა და ზოგჯერ საჭირო იყო შეფერხებები კანაგლიფლოზინით მკურნალობის დროს.
პაციენტებმა უნდა აცნობონ ინტრავასკულური მოცულობის შემცირების კლინიკურ სიმპტომებს. ამ უარყოფითმა რეაქციებმა იშვიათად გამოიწვია კანაგლიფლოზინის მოხმარების შეწყვეტა და ხშირად კანაგლიფლოზინის შემდგომი მოხმარებით გამოსწორება ანტიჰიპერტენზიული მედიკამენტების (მათ შორის დიურეზულების ჩათვლით) მიღების რეჟიმის ცვლილებით. ინტრავასკულური მოცულობის შემცირების მქონე პაციენტებში, ეს მდგომარეობა უნდა იყოს მოწესრიგებული კანაგლიფლოზინით მკურნალობის დაწყებამდე. პრეპარატი Invokana prescrib -ის მიღებამდე აუცილებელია თირკმლის ფუნქციის შეფასება. რეკომენდებულია თირკმელების ფუნქციის უფრო ხშირი მონიტორინგი GFR პაციენტებში 60 მლ / წთ / 1.73 მ 2-ზე. კანაგლიფლოზინის გამოყენება პაციენტებში, რომელთაც GFR აქვთ 45 წთ-ზე ნაკლები / 1.73 მ 2-ზე, უკუნაჩვენებია.
სიფრთხილით უნდა გამოიყენოთ კანაგლიფლოზინით ისეთ პაციენტებში, რომლებმაც არტერიული წნევის დაქვეითება პრეპარატის მიღებით შეიძლება გამოიწვიოს რისკი, მაგალითად, ცნობილი გულ-სისხლძარღვთა დაავადებების მქონე პაციენტებში, eGFR 2 პაციენტებში, პაციენტებში, რომლებიც იღებენ ანტიჰიპერტენზიულ მედიკამენტებს, არტერიული ჰიპოტენზია ისტორია პაციენტებში, რომლებიც იღებენ მარყუჟის დიურეზულობას ხანდაზმულ პაციენტებში (> 65 წლის ასაკში).
გაიზარდა ჰემატოკრიტი
კანაგლიფლოზინის გამოყენების ფონზე, აღინიშნა ჰემატოკრიტის მატება, ამიტომ სიფრთხილე უნდა იქნას გამოყენებული პრეპარატის გამოყენებისას პაციენტებში, რომლებსაც აქვთ გაზრდილი ჰემატოკრიტი.
სასქესო ორგანოების სოკოვანი ინფექციები
მას შემდეგ, რაც ნატრიუმის დამოკიდებული ტიპის 2 გლუკოზის გადამყვანთან ინჰიბირებას თან ახლავს თირკმელებით გლუკოზის ექსკრეციის მომატება, ქალებში კანდიდოზი ვულვოვაგინიტიტის და მამაკაცებში ბალანიტისა და ბალანოპოსტიტის შემთხვევების დაფიქსირება ხდება კლინიკურ კვლევებში. პაციენტები (ქალები და მამაკაცები), რომლებსაც ჰქონდათ გენიტალური ორგანოების სოკოვანი ინფექციის ისტორია, უფრო ხშირად განუვითარდათ ეს ინფექცია. განვითარდა ბალანიტი ან ბალანოპოსტიტი, პირველ რიგში, მამაკაცებში, რომელთაც არ ჰქონდათ წინადაცვეთა, დაფიქსირდა ფიმოზის შემთხვევებიც. შემთხვევების 0.2% -ში ავადმყოფებმა წინადაცვეთი გაიარეს. უმეტეს შემთხვევაში, ინფექციას მკურნალობდნენ ექიმის მიერ დადგენილი ადგილობრივი სოკოს საწინააღმდეგო აგენტები, ან მიიღეს საკუთარი ხელით მიმდინარე კანაგლიფლოზინის თერაპიის ფონზე.
გულის უკმარისობა
III ფუნქციური კლასის გულის ქრონიკულ უკმარისობაში პრეპარატის გამოყენების გამოცდილება (NYHA კლასიფიკაციის მიხედვით) შეზღუდულია. არ არსებობს გამოცდილება პრეპარატის გამოყენებასთან გულის ქრონიკული უკმარისობის IV ფუნქციურ კლასში (NYHA კლასიფიკაცია).
გავლენა ავტომობილის მართვაზე და მექანიზმებზე მუშაობაზე
აღმოჩნდა, რომ კანაგლიფლოზინს შეუძლია გავლენა მოახდინოს მანქანების მართვისა და მექანიზმებთან მუშაობის უნარზე.ამასთან, პაციენტებმა უნდა იცოდნენ ჰიპოგლიკემიის განვითარების რისკის გამოყენებისას კანაგლიფლოზინის, როგორც ინსულინთერაპიის მიმაგრების ან მისი წამლის შემცველი პრეპარატების გამოყენებისას, არასასურველი რეაქციების განვითარების უფრო მაღალი რისკის შესახებ, რომლებიც დაკავშირებულია ინტრავასკულარული მოცულობის შემცირებასთან (პოსტულარული თავბრუსხვევა) და მართვის უნარის შეზღუდვა. არასასურველი რეაქციების განვითარების მექანიზმები და მექანიზმები.
სააფთიაქო შვებულების პირობები
მწარმოებელი
მზა დოზის ფორმის წარმოება:
შპს Janssen-Ortho, 00778, სახელმწიფო გზა, 933 კმ 0.1 მაიმი ვარდი, გურაბო, პუერტო რიკო.
შეფუთვა, შეფუთვა და გამონაბოლქვი კონტროლი:
Janssen-Silag S.p.A, იტალია,
იურიდიული მისამართი: Cologno Monzeze, Milano, ul. მ. ბუონაროტი, 23.
ფაქტობრივი მისამართი: 04100, ბორგო სან მიკელი, ლატინა, ul. ჯანსენს.
რეგისტრაციის სერთიფიკატის მფლობელი, პრეტენზიების ორგანიზაცია
შპს ჯონსონი და ჯონსონი, რუსეთი, 121614, მოსკოვი, ul. კრილაცკაია, 17/2
ინსტრუქციის ეს ვერსია ძალაშია 04.29.2016 წ